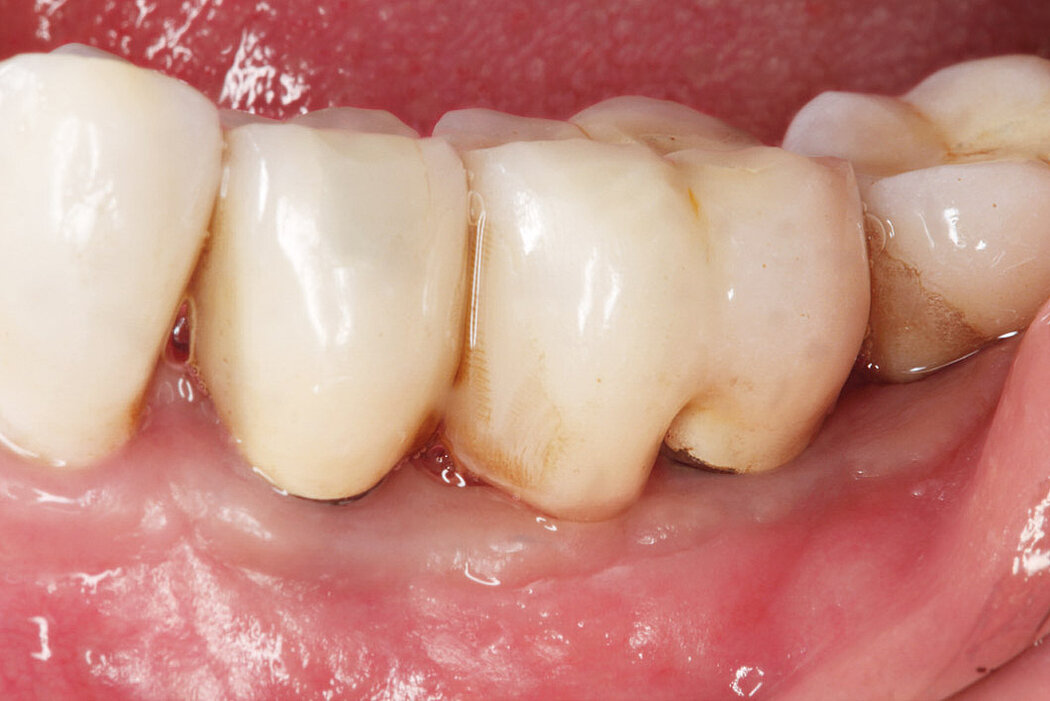
Periimplantäre Erkrankungen und deren Therapie

Erkrankungen am Implantat erkennen und therapieren
In den letzten Jahrzehnten wurden Millionen Implantate als Ersatz für fehlende Zähne inseriert. In der Literatur wird diese Therapie als insgesamt gut vorhersagbar und erfolgreich beschrieben. Als wesentliche (Spät-) Komplikationen scheinen sich periimplantäre Entzündungen abzuzeichnen.
Die Prävalenz der periimplantären Mukositis wird neueren Übersichtsarbeiten zufolge auf ca. 43% geschätzt, wohingegen die Periimplantitis ca. 22% der Implantatpatienten zu betreffen scheint.1 Da nicht rechtzeitig diagnostizierte und behandelte periimplantäre Entzündungen langfristig zum Implantatverlust führen können, kommt auf den Behandler schon mit der korrekten Diagnostik eine wichtige Aufgabe zu.
Inwieweit lassen sich periimplantäre Entzündungen unterscheiden und wie könnten entsprechende rekonstruktive und ggf. auch regenerative Therapieansätze aussehen?
2017 wurde die Klassifikation der Periimplantitis neu definiert.2 Während die periimplantäre Mukositis visuelle Zeichen einer Entzündung – meist plaquebedingt – zeigt und BOP aufweist, werden der Periimplantitis noch weitere ergänzende Merkmale wie fortschreitender Knochenverlust und ein nichtlinearer und beschleunigter Krankheitsverlauf zugewiesen.
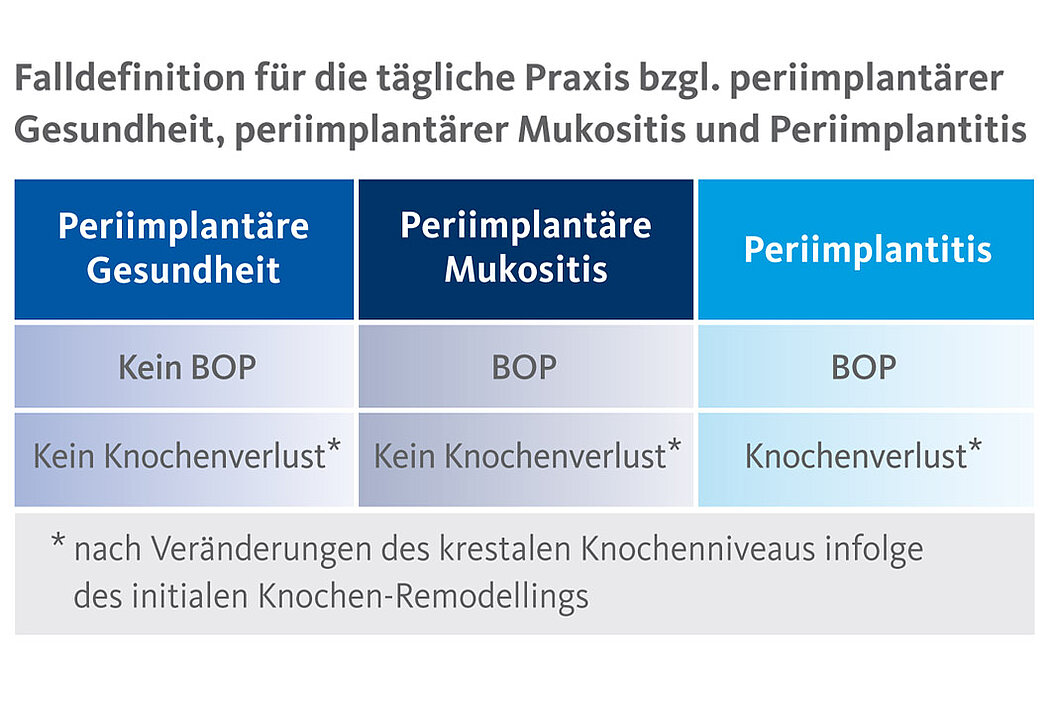
Sowohl lokale Risikofaktoren, wie die Fehlpositionierung eines Implantats, fehlende fixierte und keratinisierte Mukosa, Auswahl des Implantatdesigns und die Schnittführung bei der Implantation, als auch andere systematische Risikofaktoren (bspw. Genetik, Nikotin, Diabetes Mellitus) scheinen für die Entstehung periimplantärer Entzüngungen verantwortlich zu sein. Maßgeblich werden aber als Hauptursache für die periimplantären Gewebeschädigungen inflammatorische Prozesse durch die Biofilmbildungen gesehen, die unter Umständen auch auf eine mangelnde Mundhygiene bzw. Prävention zurückzuführen sind.
Der Ersatz fehlender Zähne durch Implantate gehört in Deutschland mittlerweile zu den standardmäßigen Therapieangeboten in zahnärztlich-chirurgischen Praxen.
Die Basis für die periimplantäre Gesundheit Ihres Patienten und den Langzeiterfolg des inserierten Implantates sind stabile und gesunde Hart- und Weichgewebeverhältnisse. Mit entsprechenden augmentativen Maßnahmen lassen sich mögliche Gewebedefizite bereits mit oder schon vor der Implantation ausgleichen. Hier haben sich verschiedene Konzepte bewährt, die Sie bereits im ersten Teil „Augmentationskonzepte für den Langzeiterfolg von Implantaten“ kennenlernten konnten.
Neben den fachlich-chirurgischen Fähigkeiten des Behandlers, trägt auch die Patienten-Compliance wesentlich zur periimplantären Gesundheit bei.
Um hier mögliche Defizite schnell zu erkennen und gegenzusteuern, haben sich regelmäßige Recallsitzungen bewährt, bei denen ein ausführlicher Mundhygienestatus erhoben wird.
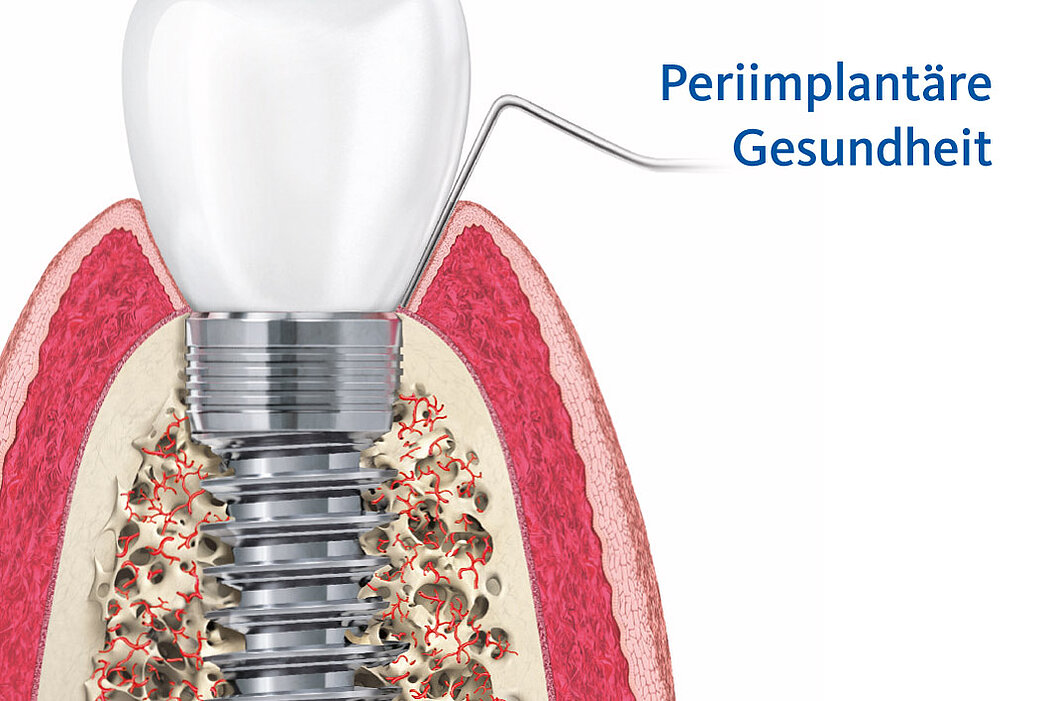
Zeigen sich keine Auffälligkeiten, wie bspw. beginnende Entzündungsanzeichen, spricht man von periimplantärer Gesundheit.
Die periimplantäre Gesundheit des Patienten lässt sich anhand folgender Parameter feststellen2:
- Fehlen von klinischen Anzeichen einer Entzündung (wie Schwellungen, Rötungen)
- Fehlen von Blutungen (BOP)/Eiteraustritt bei sanfter Sondierung
- Keine Erhöhung der Sondierungstiefen im Vergleich zu früheren Untersuchungen
- Kein Knochenabbau
Durch eine professionelle Implantat- und Zahnreinigung lässt sich die periimplantäre Gesundheit der Patienten aufrechterhalten und hilft so, einer periimplantären Mukositis wirksam vorzubeugen.
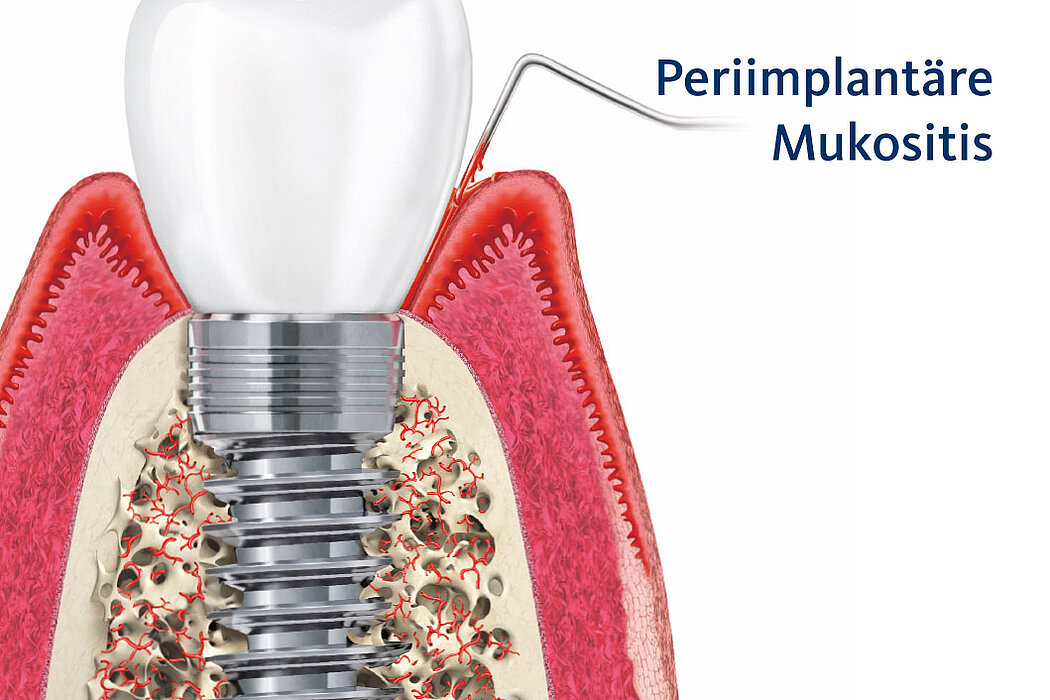
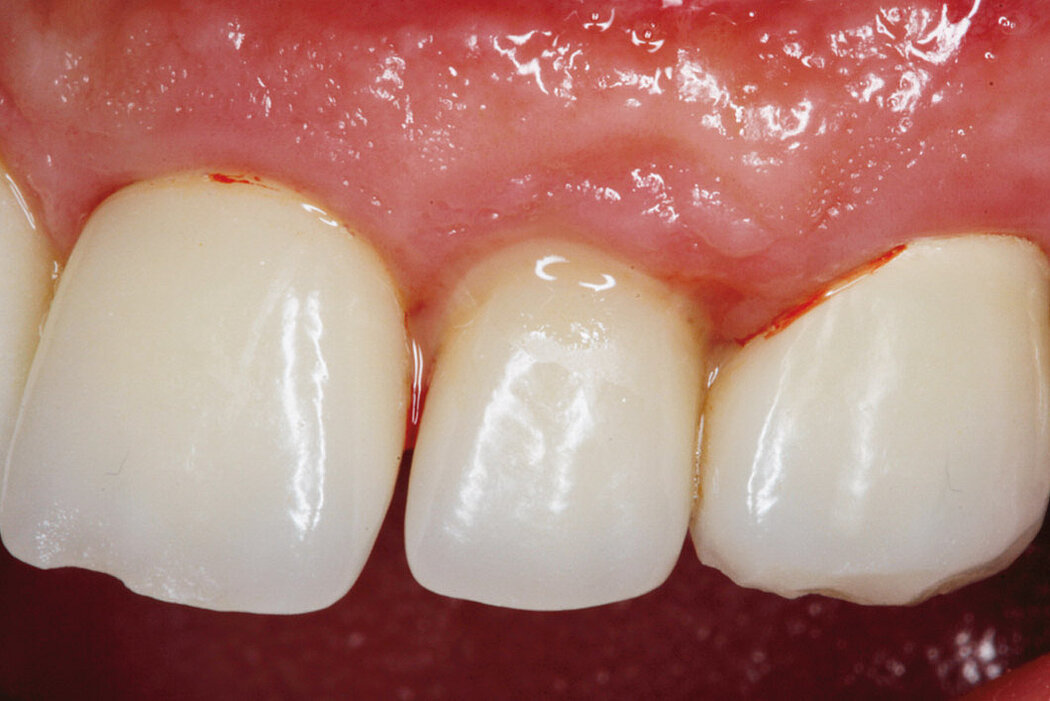
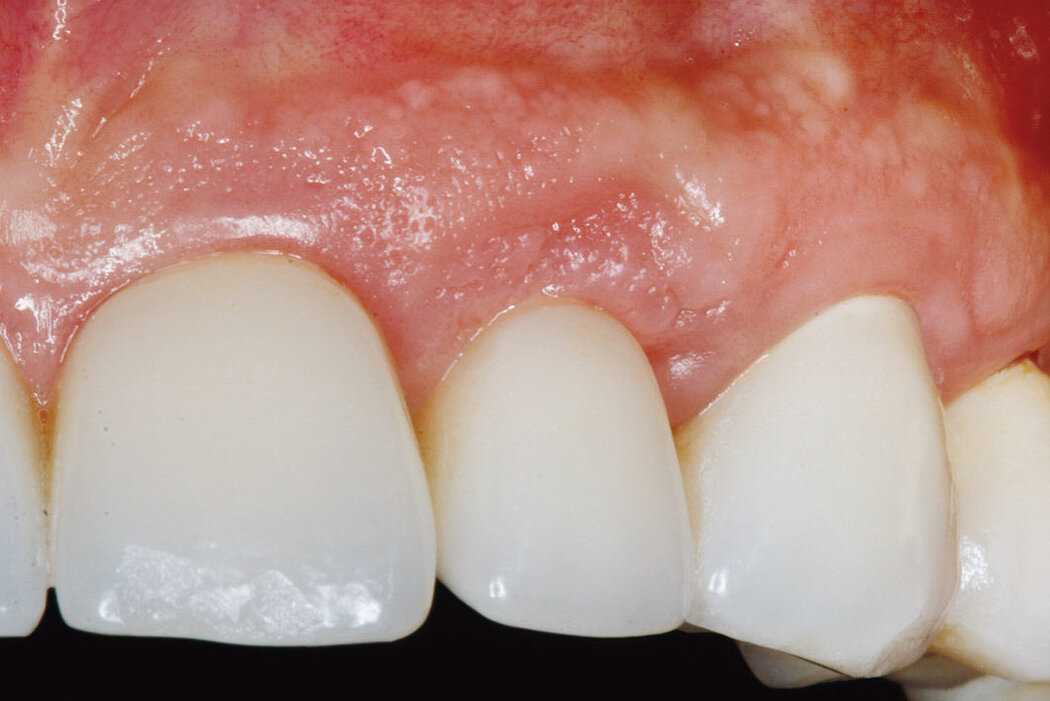
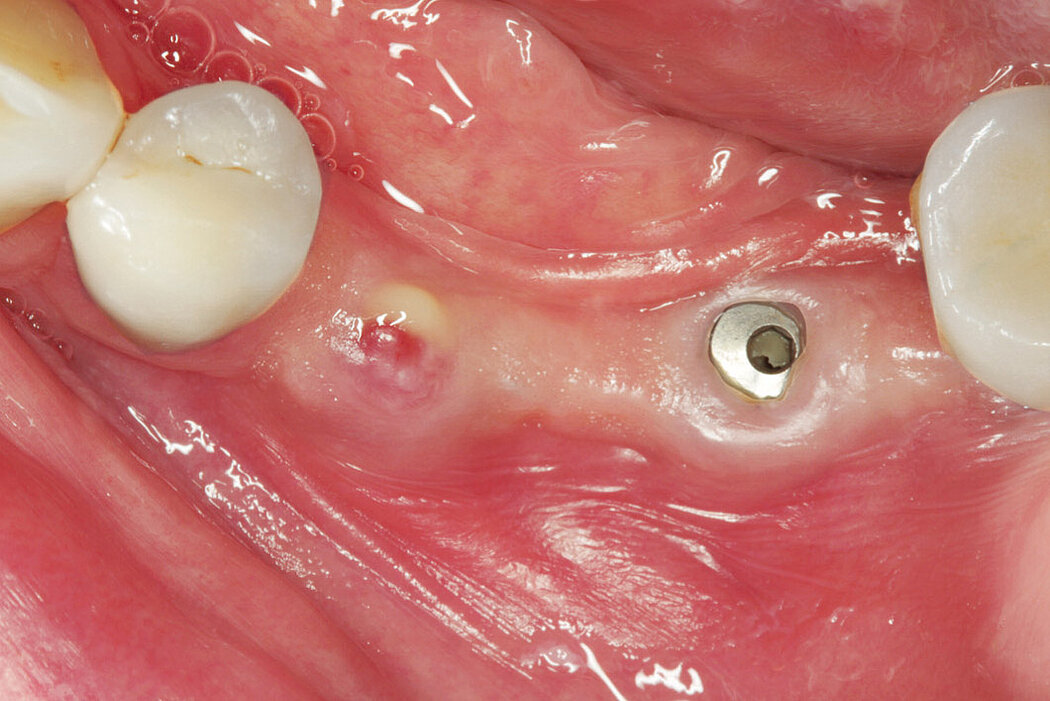
Sind im Rahmen der regelmäßigen Kontrolluntersuchungen am periimplantären Weichgewebe visuelle Anzeichen einer Entzündung zu erkennen, lässt dies häufig auf eine periimplantäre Mukositis schließen.
Die Ursache der periimplantären Mukositis ist – analog einer Gingivitis – in einer Plaqueakkumulation zu sehen und damit auch reversibel. In den meisten Fällen ist eine nichtchirurgische Intervention ausreichend.
Bleibt die periimplantäre Mukositis unbehandelt, kann diese sich zu einer Periimplantitis entwickeln!3
Die richtige Diagnose gerne – aber wie?
Für die klinische Basisdiagnostik sollte ein vorsichtiger periimplantärer Sondierungsvorgang mit moderatem Druck herangezogen werden.4 Dabei ist zu beachten, dass sich durch die vorherige Abnahme der Suprakonstruktion, die Genauigkeit und Reproduzierbarkeit des Sondierungsvorganges erheblich verbessern lässt.5 Radiologische Kontrollaufnahmen sind gemäß aktueller S3-Leitlinie erst dann indiziert, wenn klinische Entzündungszeichen (positiver BOP sowie putride Exsudation) sowie die Zunahme der Sondierungstiefe vorliegen.6
Anzeichen der periimplantären Mukositis2:
- Blutung (BOP) und/oder Eiterung bei sanfter Sondierung
- Kein Knochenabbau
Lasertherapien (Er:YAG-Laser), Pulverstrahlgeräte (Air-Polishing mit Glycinpulver), Ultraschallsysteme aber auch adjuvante antiseptische/antibiotische Therapien, wie lokale Antibiotika oder Antiseptika (CHX Chips) oder antimikrobieller photodynamische Therapien, die zur Entfernung des Biofilms angewandt werden, zählen zu weiteren unterstützenden Verfahren.
Neben dem professionellen manuellen Debridement lässt sich der Therapieerfolg durch eine Optimierung der häuslichen Mundhygiene durch den Patienten zudem positiv beeinflussen.7
- Stein J M, Kämmerer P W. Periimplantäre Entzündungen – die Herausforderung unserer Zeit?. wissen kompakt 14, 1–2 (2020). (editorial)
- Berglundh T et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. Journal of periodontology vol. 89 Suppl 1 (2018): S313–S318. (consensus report)
- Froum S J et al. Peri-implant Mucositis. The International journal of periodontics & restorative dentistry vol. 39,2 (2019): e46–e57. (review)
- Lindhe J et al. Peri-implant diseases: Consensus Report of the Sixth European Workshop on Periodontology. Journal of clinical periodontology vol. 35,8 Suppl (2008): 282-5. (review)
- Serino G et al. Probing at implants with peri-implantitis and its relation to clinical peri-implant bone loss.Clinical oral implants research vol. 24,1 (2013): 91–5. (clinical study)
- Schwarz F, Becker L, AWMF. S3-Leitlinie: Die Behandlung periimplantärer Infektionen an Zahnimplantaten.AWMF (2016). (Leitlinie)
- Salvi G E, Ramseier C A. Efficacy of patient-administered mechanical and/or chemical plaque control protocols in the management of peri-implant mucositis. A systematic review. Journal of clinical periodontology vol.42 Suppl 16 (2014): S 187–201. (systematic review)
- Schwarz F, Becker J. Periimplantäre Infektionen. Ein Update zur Epidemiologie, Ätiologie, Diagnostik, Prävention und Therapie. Quintessenz Implantologie 23 (2015): 1–13. (Übersichtsartikel)
- Lang N P et al. Periimplant diseases: where are we now? –Consensus of the Seventh European Workshop on Periodontology. Journal of clinical periodontology vol. 38 Suppl 11 (2011): 178–81. (consensus report)
- Ratka C et al. The Effect of In Vitro Electrolytic Cleaning on Biofilm-Contaminated Implant Surfaces. Journal of clinical medicine vol. 8,9 1397. 6 Sep. 2019. (in vitro)
- Schlee M et al. Treatment of Peri-implantitis-Electrolytic Cleaning Versus Mechanical and Electrolytic Cleaning- A Randomized Controlled Clinical Trial-Six-Month Results. Journal of clinical medicine vol. 8,11 1909. 7Nov.2019. (in vitro)
- Schlee M et al. Is Complete Re-Osseointegration of an Infected Dental Implant Possible? Histologic Results of a Dog Study: A Short Communication. Journal of clinical medicine vol. 9,1 235. 16 Jan. 2020. (in vitro)
- Romeo E et al. Therapy of peri-implantitis with resective surgery. A 3-year clinical trial on rough screw-shaped oral implants. Part I: clinical outcome. Clinical oral implants research vol. 16,1 (2005): 9–18. (clinical case study)
- Meier R M et al. Surface quality after implantoplasty. Schweizer Monatsschrift für Zahnmedizin vol. 122,9 (2012): 714–24. (material scientific study)
- Monje A et al. Morphology and severity of peri-implantitis bone defects. Clinical implant dentistry and related research vol. 21,4 (2019): 635–643. (review)
- Schwarz F et al. Healing of intrabony peri-implantitis defects following application of a nanocrystalline hydroxyapatite (Ostim) or a bovine-derived xenograft (Bio-Oss) in combination with a collagen membrane (Bio-Gide). A case series. Journal of clinical periodontology vol. 33,7 (2006): 491–9. (clinical case series)
- Schwarz F et al. Two-year clinical results following treatment of peri-implantitis lesions using a nanocrystalline hydroxyapatite or a natural bone mineral in combination with a collagen membrane. Journal of clinical periodontology vol. 35,1 (2008): 80–7. (clinical case series)
- Aghazadeh A et al. A single-centre randomized controlled clinical trial on the adjunct treatment of intra-bony defects with autogenous bone or a xenograft: results after 12 months. Journal of clinical periodontology vol. 39,7 (2012): 666–73. (clinical case study)
- Roccuzzo M et al. Surgical therapy of single peri-implantitis intrabony defects, by means of deproteinized bovine bone mineral with 10% collagen. Journal of clinical periodontology vol. 43,3 (2016): 311-8. (clinical study)
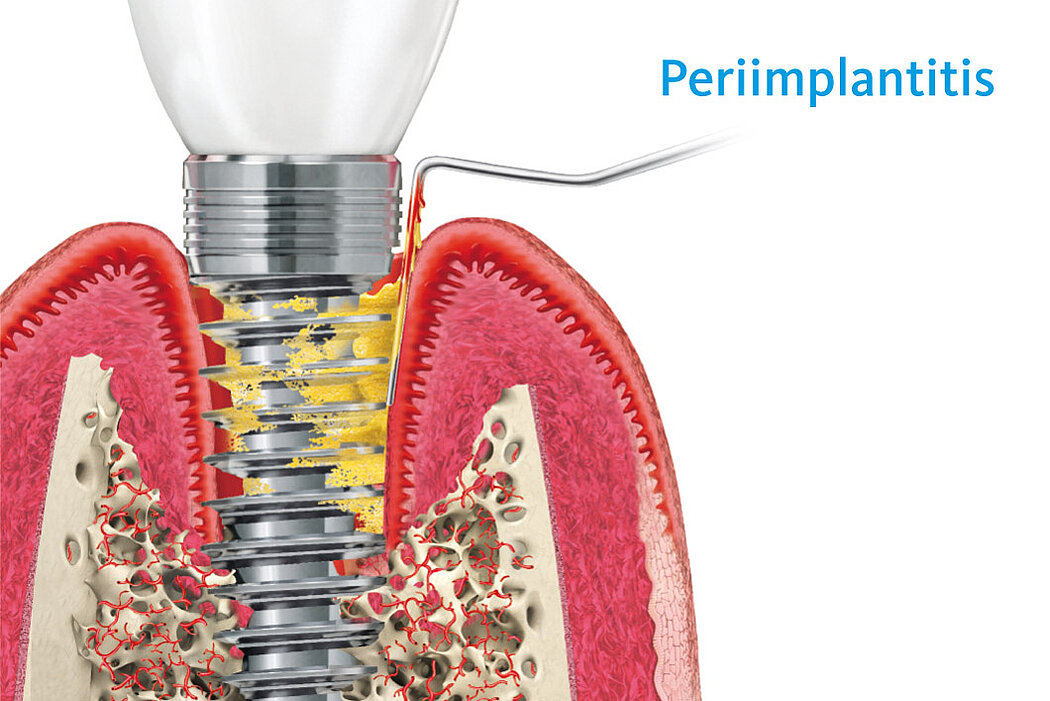
Die Periimplantitis weist primär die gleichen Entzündungszeichen wie die periimplantäre Mukositis auf. Allerdings lassen sich anhand weiterer Merkmale die Unterschiede zwischen Mukositis und Periimplantitis gut erkennen.
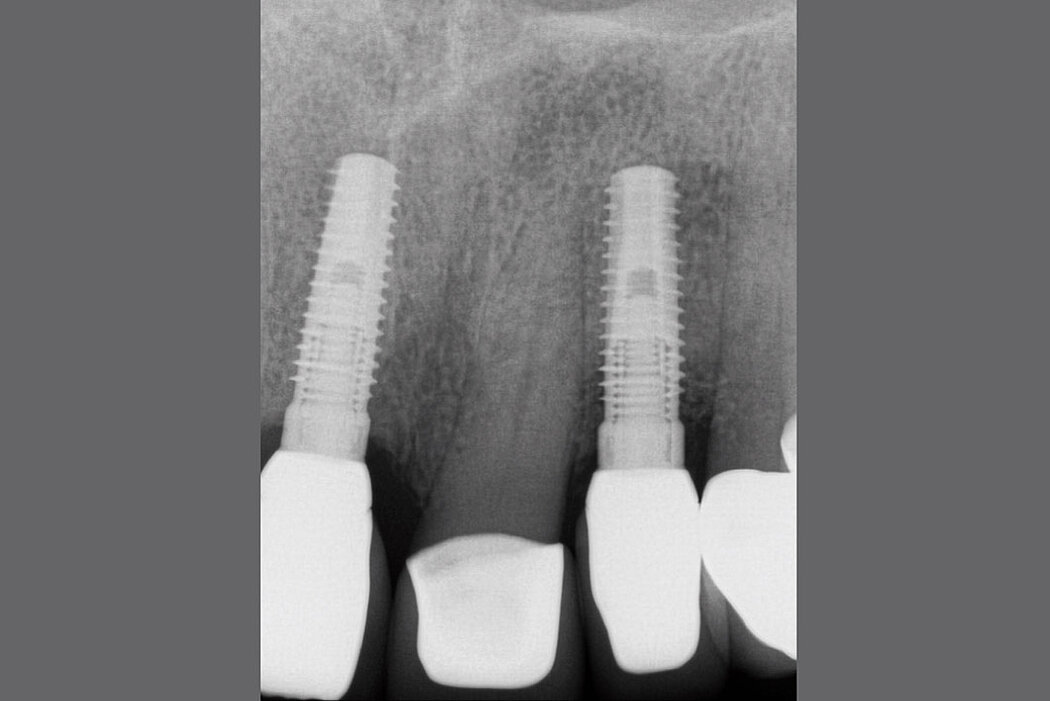
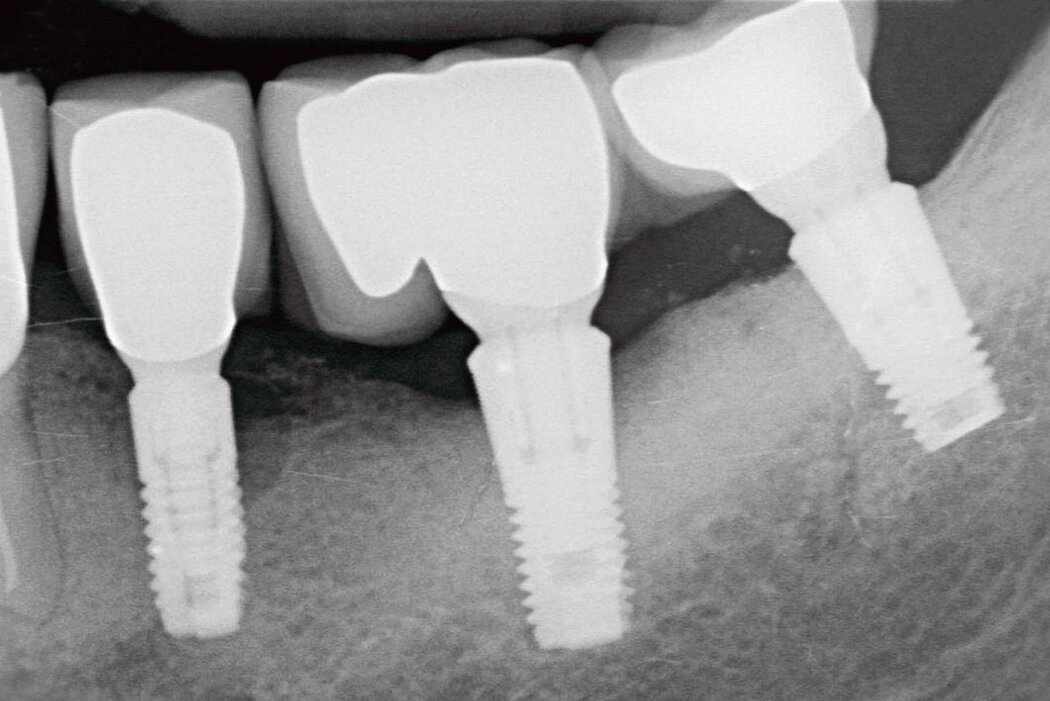
Bei einer Periimplantitis zeigen sich zu den bereits beschriebenen Entzündungszeichen zusätzlich ein fortschreitender – radiologisch nachweisbarer – Knochenverlust sowie ein nichtlinearer und beschleunigter Krankheitsverlauf.
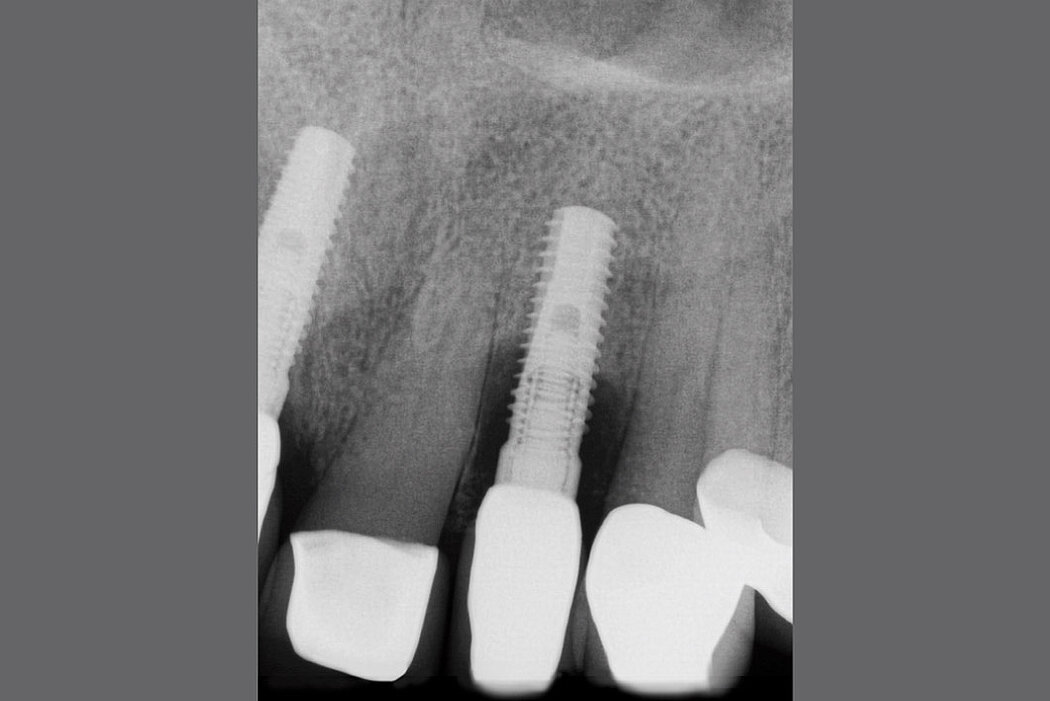
Hinsichtlich des Knochenabbaus ist zu beachten, dass physiologische Remodellierungsvorgänge von infektiös bedingten, progredient verlaufenden Knochenresorptionen unterschieden werden müssen.8 Aus diesem Grunde empfiehlt sich bei allen Implantatversorgungen die Anfertigung einer radiologischen Referenzaufnahme, welche idealerweise zum Zeitpunkt der Eingliederung der Suprakonstruktion angefertigt werden sollte.9 Somit lassen sich die physiologischen Umbauvorgänge während und nach einer Implantatinsertion dokumentieren und eine zuverlässige Referenz zur Bewertung pathologischer Knochenresorptionen im zeitlichen Intervall definieren.
Periimplantitis ist ein plaque-assoziierter pathologischer Zustand, der in den Geweben um Zahnimplantate herum auftritt. Charakteristisch zeigen sich2:
- Blutung (BOP) und/oder Eiterung bei sanfter Sondierung
- Erhöhte Sondierungstiefe im Vergleich zu früheren Untersuchungen
- Knochenabbau
Zur Eliminierung der klinischen Anzeichen der Infektion und der Reduktion der Sondierungstiefen beginnt die Behandlung der Periimplantitis zunächst mit der nichtchirurgischen Therapie und wird durch chirurgische oder chirurgisch-kombinierte Behandlungsmethoden ergänzt.
Vor Beginn der Therapie sollte das angestrebte Therapieziel, die Behandlungsprognose sowie der Therapie und Kostenaufwand eng mit dem Patienten abgestimmt werden.
Implantaterhalt und Re-Osseointegration
Ist eine langfristig erfolgreiche Periimplantitis-Therapie mit einer Re-Osseointegration des Implantats Ziel der Therapie, lässt sich dies nur mit einer vollständigen Eliminierung des Biofilms bzw. der Dekontamination der Implantatoberfläche erreichen.
Zur Reduktion des Biofilms werden verschiedene Methoden und Hilfsmittel (bspw. Küretten aus Kunststoff oder Titan, Titanbürsten, Ultraschallsysteme, Laser, Pulverstrahlgeräte, antimikrobielle photodynamische Therapien) angeboten. Allerdings konnte mit keiner der benannten Methoden die komplette Entfernung des Biofilms wissenschaftlich nachgewiesen werden.
Lediglich ein Verfahren (GalvoSurge®) zeigte eine vollständige Dekontamination der Implantatoberfläche und ermöglicht damit auch eine Re-Osseointegration des Implants. In mehreren Studien konnte die komplette Entfernung des Biofilms mittels elektrolytischem Verfahren nachgewiesen werden.10-12
Rekonstruktion: Implantaterhalt ohne vollständige Re-Osseointegration
Lässt sich eine Re-Osseointegration des erkrankten Implantats mangels vollständiger Elimination des Biofilms durch die angewandte Methode nicht erreichen, kann im Sinne einer Rekonstruktion, das Implantat dennoch in situ gehalten werden. Das Therapieziel „Implantaterhalt“ geht einher mit stabilen Hart- und Weichgewebeverhältnissen. Wie langfristig erfolgreich diese rekonstruierte Situation anhält, ist wissenschaftlich nicht belegt.
Implantaterhalt durch chirurgisch-resektive Maßnahmen
Ist eine Periimplantitis-Therapie unter Anwendung regenerativer Maßnahmen aufgrund defektspezifischer Faktoren (Defektanatomie, fehlpositioniertes Implantat) oder auch patientenspezifischer Faktoren (allgemeinmedizinische Einflüsse) kontraindiziert, stehen dem Behandler noch die chirurgisch-resektiven Therapiemethoden zur Verfügung.
Beim resektiven Therapieansatz wird das periimplantäre Weichgewebe mit dem Ziel der „Taschenelimination“ auf das Niveau des knöchernen Defektes verlagert.13 Neben der Weichteilexzision unter Erhalt von marginal mindestens 3 mm keratinisierter Mukosa können die Osteotomie zur Schaffung einer positiven Knochenarchitektur sowie die Implantatplastik, das heißt eine Glättung der rauen Implantatoberfläche mit rotierenden Instrumenten, indiziert sein. Die Implantatplastik wird an dem später in die Mundhöhle exponierten Anteil durchgeführt, um dort eine erneute bakterielle Adhäsion zu verringern, die Reinigbarkeit zu optimieren und somit einer erneuten Periimplantitis vorzubeugen.14
Explantation
Eine Explantation sollte bei vorliegender Implantatlockerung, nicht behebbaren technischen Komplikationen, komplexen Implantatdesigns (z. B.Hohlzylinder), Therapieresistenz oder Übergreifen der Infektion auf anatomische Nachbarstrukturen erfolgen.6
Regenerationspotenzial in Abhängigkeit der Defektklassen
Abhängig von der Schwere, bzw. der Ausdehnung der periimplantären Knochenschädigung lassen sich die entstandenen Defektgeometrien in unterschiedliche Klassen eingruppieren.15
- Stein J M, Kämmerer P W. Periimplantäre Entzündungen – die Herausforderung unserer Zeit?. wissen kompakt 14, 1–2 (2020). (editorial)
- Berglundh T et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. Journal of periodontology vol. 89 Suppl 1 (2018): S313–S318. (consensus report)
- Froum S J et al. Peri-implant Mucositis. The International journal of periodontics & restorative dentistry vol. 39,2 (2019): e46–e57. (review)
- Lindhe J et al. Peri-implant diseases: Consensus Report of the Sixth European Workshop on Periodontology. Journal of clinical periodontology vol. 35,8 Suppl (2008): 282-5. (review)
- Serino G et al. Probing at implants with peri-implantitis and its relation to clinical peri-implant bone loss.Clinical oral implants research vol. 24,1 (2013): 91–5. (clinical study)
- Schwarz F, Becker L, AWMF. S3-Leitlinie: Die Behandlung periimplantärer Infektionen an Zahnimplantaten.AWMF (2016). (Leitlinie)
- Salvi G E, Ramseier C A. Efficacy of patient-administered mechanical and/or chemical plaque control protocols in the management of peri-implant mucositis. A systematic review. Journal of clinical periodontology vol.42 Suppl 16 (2014): S 187–201. (systematic review)
- Schwarz F, Becker J. Periimplantäre Infektionen. Ein Update zur Epidemiologie, Ätiologie, Diagnostik, Prävention und Therapie. Quintessenz Implantologie 23 (2015): 1–13. (Übersichtsartikel)
- Lang N P et al. Periimplant diseases: where are we now? –Consensus of the Seventh European Workshop on Periodontology. Journal of clinical periodontology vol. 38 Suppl 11 (2011): 178–81. (consensus report)
- Ratka C et al. The Effect of In Vitro Electrolytic Cleaning on Biofilm-Contaminated Implant Surfaces. Journal of clinical medicine vol. 8,9 1397. 6 Sep. 2019. (in vitro)
- Schlee M et al. Treatment of Peri-implantitis-Electrolytic Cleaning Versus Mechanical and Electrolytic Cleaning- A Randomized Controlled Clinical Trial-Six-Month Results. Journal of clinical medicine vol. 8,11 1909. 7Nov.2019. (in vitro)
- Schlee M et al. Is Complete Re-Osseointegration of an Infected Dental Implant Possible? Histologic Results of a Dog Study: A Short Communication. Journal of clinical medicine vol. 9,1 235. 16 Jan. 2020. (in vitro)
- Romeo E et al. Therapy of peri-implantitis with resective surgery. A 3-year clinical trial on rough screw-shaped oral implants. Part I: clinical outcome. Clinical oral implants research vol. 16,1 (2005): 9–18. (clinical case study)
- Meier R M et al. Surface quality after implantoplasty. Schweizer Monatsschrift für Zahnmedizin vol. 122,9 (2012): 714–24. (material scientific study)
- Monje A et al. Morphology and severity of peri-implantitis bone defects. Clinical implant dentistry and related research vol. 21,4 (2019): 635–643. (review)
- Schwarz F et al. Healing of intrabony peri-implantitis defects following application of a nanocrystalline hydroxyapatite (Ostim) or a bovine-derived xenograft (Bio-Oss) in combination with a collagen membrane (Bio-Gide). A case series. Journal of clinical periodontology vol. 33,7 (2006): 491–9. (clinical case series)
- Schwarz F et al. Two-year clinical results following treatment of peri-implantitis lesions using a nanocrystalline hydroxyapatite or a natural bone mineral in combination with a collagen membrane. Journal of clinical periodontology vol. 35,1 (2008): 80–7. (clinical case series)
- Aghazadeh A et al. A single-centre randomized controlled clinical trial on the adjunct treatment of intra-bony defects with autogenous bone or a xenograft: results after 12 months. Journal of clinical periodontology vol. 39,7 (2012): 666–73. (clinical case study)
- Roccuzzo M et al. Surgical therapy of single peri-implantitis intrabony defects, by means of deproteinized bovine bone mineral with 10% collagen. Journal of clinical periodontology vol. 43,3 (2016): 311-8. (clinical study)

Die Lage, Größe und Wandigkeit eines periimplantären Knochendefektes spielen auch bei der Wahl des Therapiekonzeptes eine entscheidende Rolle, da nicht alle Defekte gleich rekonstruiert oder gar regeneriert werden können. Jedoch besteht durchaus ein Zusammenhang zwischen der Defektgeometrie und dem Erfolg einer regenerativen Behandlung.15
Insbesondere mit Hinblick auf eine knöcherne Regeneration ist neben der kompletten und nachhaltigen Entfernung des Biofilms auch die biologische Kompetenz des Umgebungsgewebes von ausschlaggebender Bedeutung. Je mehr „knöcherne Wände“ den Defekt um das Implantat umgeben, desto erfolgversprechsender ist eine Augmentation mit dem Ziel der Knochenregeneration.
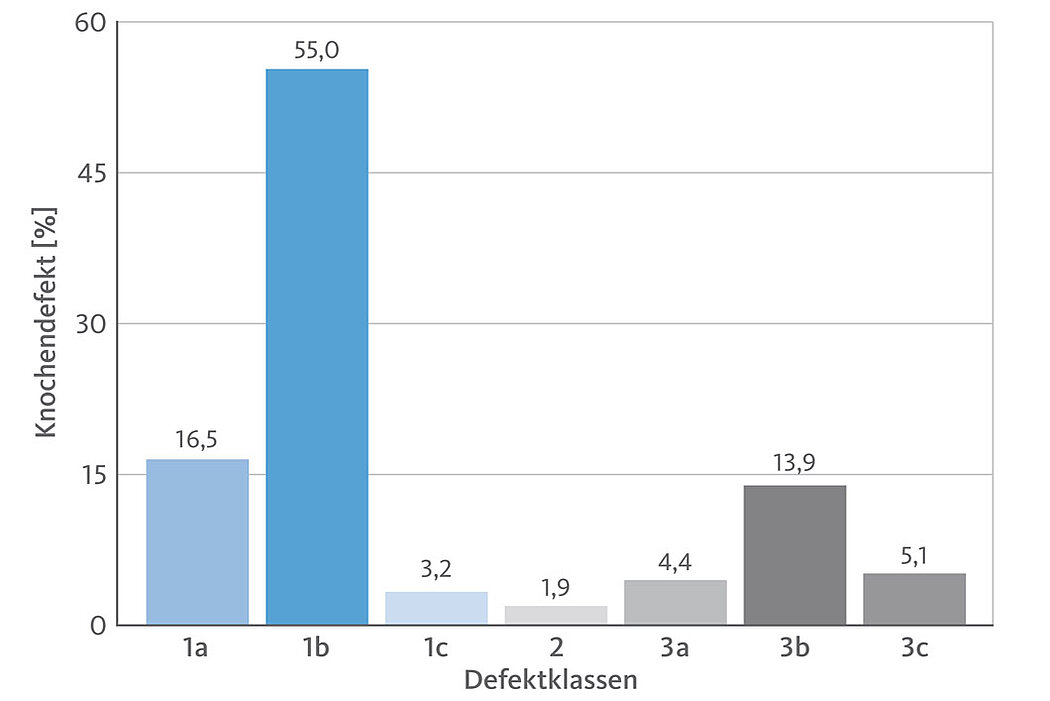
Untersuchungen von Monje et al. haben gezeigt, dass ein Großteil der untersuchten Defektgeometrien aus bukkalen Dehiszenzen (16,5%) und 2–3 wandigen Defekten (55%) bestehen, die diesbezüglich ein großes Regenerationspotential aufweisen, ähnlich wie beispielsweise vergleichbare Defekte mit einem zusätzlichen vertikalen Knochenverlust, wenn dieser frühzeitig erkannt wird und noch nicht all zu sehr ausgeprägt ist (Defekte der Klasse 3, ca. 23% der periimplantären Knochendefekte).15
- Stein J M, Kämmerer P W. Periimplantäre Entzündungen – die Herausforderung unserer Zeit?. wissen kompakt 14, 1–2 (2020). (editorial)
- Berglundh T et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. Journal of periodontology vol. 89 Suppl 1 (2018): S313–S318. (consensus report)
- Froum S J et al. Peri-implant Mucositis. The International journal of periodontics & restorative dentistry vol. 39,2 (2019): e46–e57. (review)
- Lindhe J et al. Peri-implant diseases: Consensus Report of the Sixth European Workshop on Periodontology. Journal of clinical periodontology vol. 35,8 Suppl (2008): 282-5. (review)
- Serino G et al. Probing at implants with peri-implantitis and its relation to clinical peri-implant bone loss.Clinical oral implants research vol. 24,1 (2013): 91–5. (clinical study)
- Schwarz F, Becker L, AWMF. S3-Leitlinie: Die Behandlung periimplantärer Infektionen an Zahnimplantaten.AWMF (2016). (Leitlinie)
- Salvi G E, Ramseier C A. Efficacy of patient-administered mechanical and/or chemical plaque control protocols in the management of peri-implant mucositis. A systematic review. Journal of clinical periodontology vol.42 Suppl 16 (2014): S 187–201. (systematic review)
- Schwarz F, Becker J. Periimplantäre Infektionen. Ein Update zur Epidemiologie, Ätiologie, Diagnostik, Prävention und Therapie. Quintessenz Implantologie 23 (2015): 1–13. (Übersichtsartikel)
- Lang N P et al. Periimplant diseases: where are we now? –Consensus of the Seventh European Workshop on Periodontology. Journal of clinical periodontology vol. 38 Suppl 11 (2011): 178–81. (consensus report)
- Ratka C et al. The Effect of In Vitro Electrolytic Cleaning on Biofilm-Contaminated Implant Surfaces. Journal of clinical medicine vol. 8,9 1397. 6 Sep. 2019. (in vitro)
- Schlee M et al. Treatment of Peri-implantitis-Electrolytic Cleaning Versus Mechanical and Electrolytic Cleaning- A Randomized Controlled Clinical Trial-Six-Month Results. Journal of clinical medicine vol. 8,11 1909. 7Nov.2019. (in vitro)
- Schlee M et al. Is Complete Re-Osseointegration of an Infected Dental Implant Possible? Histologic Results of a Dog Study: A Short Communication. Journal of clinical medicine vol. 9,1 235. 16 Jan. 2020. (in vitro)
- Romeo E et al. Therapy of peri-implantitis with resective surgery. A 3-year clinical trial on rough screw-shaped oral implants. Part I: clinical outcome. Clinical oral implants research vol. 16,1 (2005): 9–18. (clinical case study)
- Meier R M et al. Surface quality after implantoplasty. Schweizer Monatsschrift für Zahnmedizin vol. 122,9 (2012): 714–24. (material scientific study)
- Monje A et al. Morphology and severity of peri-implantitis bone defects. Clinical implant dentistry and related research vol. 21,4 (2019): 635–643. (review)
- Schwarz F et al. Healing of intrabony peri-implantitis defects following application of a nanocrystalline hydroxyapatite (Ostim) or a bovine-derived xenograft (Bio-Oss) in combination with a collagen membrane (Bio-Gide). A case series. Journal of clinical periodontology vol. 33,7 (2006): 491–9. (clinical case series)
- Schwarz F et al. Two-year clinical results following treatment of peri-implantitis lesions using a nanocrystalline hydroxyapatite or a natural bone mineral in combination with a collagen membrane. Journal of clinical periodontology vol. 35,1 (2008): 80–7. (clinical case series)
- Aghazadeh A et al. A single-centre randomized controlled clinical trial on the adjunct treatment of intra-bony defects with autogenous bone or a xenograft: results after 12 months. Journal of clinical periodontology vol. 39,7 (2012): 666–73. (clinical case study)
- Roccuzzo M et al. Surgical therapy of single peri-implantitis intrabony defects, by means of deproteinized bovine bone mineral with 10% collagen. Journal of clinical periodontology vol. 43,3 (2016): 311-8. (clinical study)
Rekonstruktion mit Geistlich Bio-Oss® und Bio-Gide®
Untersuchungen von Schwarz et al. haben ergeben, dass periimplantäre Defekte, die nach Reinigung durch Plastikküretten und steriler Kochsalzlösung sowie anschließender Augmentation mit Geistlich Bio-Oss® und Geistlich Bio-Gide® bezüglich der Sondierungstiefe, des klinischen Attachment-Levels sowie des BOP über einen Beobachtungszeitraum von zwei Jahren nach Augmentation stabile und deutlich bessere Werte aufwiesen als vor dem Eingriff. 16,17
- Stein J M, Kämmerer P W. Periimplantäre Entzündungen – die Herausforderung unserer Zeit?. wissen kompakt 14, 1–2 (2020). (editorial)
- Berglundh T et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. Journal of periodontology vol. 89 Suppl 1 (2018): S313–S318. (consensus report)
- Froum S J et al. Peri-implant Mucositis. The International journal of periodontics & restorative dentistry vol. 39,2 (2019): e46–e57. (review)
- Lindhe J et al. Peri-implant diseases: Consensus Report of the Sixth European Workshop on Periodontology. Journal of clinical periodontology vol. 35,8 Suppl (2008): 282-5. (review)
- Serino G et al. Probing at implants with peri-implantitis and its relation to clinical peri-implant bone loss.Clinical oral implants research vol. 24,1 (2013): 91–5. (clinical study)
- Schwarz F, Becker L, AWMF. S3-Leitlinie: Die Behandlung periimplantärer Infektionen an Zahnimplantaten.AWMF (2016). (Leitlinie)
- Salvi G E, Ramseier C A. Efficacy of patient-administered mechanical and/or chemical plaque control protocols in the management of peri-implant mucositis. A systematic review. Journal of clinical periodontology vol.42 Suppl 16 (2014): S 187–201. (systematic review)
- Schwarz F, Becker J. Periimplantäre Infektionen. Ein Update zur Epidemiologie, Ätiologie, Diagnostik, Prävention und Therapie. Quintessenz Implantologie 23 (2015): 1–13. (Übersichtsartikel)
- Lang N P et al. Periimplant diseases: where are we now? –Consensus of the Seventh European Workshop on Periodontology. Journal of clinical periodontology vol. 38 Suppl 11 (2011): 178–81. (consensus report)
- Ratka C et al. The Effect of In Vitro Electrolytic Cleaning on Biofilm-Contaminated Implant Surfaces. Journal of clinical medicine vol. 8,9 1397. 6 Sep. 2019. (in vitro)
- Schlee M et al. Treatment of Peri-implantitis-Electrolytic Cleaning Versus Mechanical and Electrolytic Cleaning- A Randomized Controlled Clinical Trial-Six-Month Results. Journal of clinical medicine vol. 8,11 1909. 7Nov.2019. (in vitro)
- Schlee M et al. Is Complete Re-Osseointegration of an Infected Dental Implant Possible? Histologic Results of a Dog Study: A Short Communication. Journal of clinical medicine vol. 9,1 235. 16 Jan. 2020. (in vitro)
- Romeo E et al. Therapy of peri-implantitis with resective surgery. A 3-year clinical trial on rough screw-shaped oral implants. Part I: clinical outcome. Clinical oral implants research vol. 16,1 (2005): 9–18. (clinical case study)
- Meier R M et al. Surface quality after implantoplasty. Schweizer Monatsschrift für Zahnmedizin vol. 122,9 (2012): 714–24. (material scientific study)
- Monje A et al. Morphology and severity of peri-implantitis bone defects. Clinical implant dentistry and related research vol. 21,4 (2019): 635–643. (review)
- Schwarz F et al. Healing of intrabony peri-implantitis defects following application of a nanocrystalline hydroxyapatite (Ostim) or a bovine-derived xenograft (Bio-Oss) in combination with a collagen membrane (Bio-Gide). A case series. Journal of clinical periodontology vol. 33,7 (2006): 491–9. (clinical case series)
- Schwarz F et al. Two-year clinical results following treatment of peri-implantitis lesions using a nanocrystalline hydroxyapatite or a natural bone mineral in combination with a collagen membrane. Journal of clinical periodontology vol. 35,1 (2008): 80–7. (clinical case series)
- Aghazadeh A et al. A single-centre randomized controlled clinical trial on the adjunct treatment of intra-bony defects with autogenous bone or a xenograft: results after 12 months. Journal of clinical periodontology vol. 39,7 (2012): 666–73. (clinical case study)
- Roccuzzo M et al. Surgical therapy of single peri-implantitis intrabony defects, by means of deproteinized bovine bone mineral with 10% collagen. Journal of clinical periodontology vol. 43,3 (2016): 311-8. (clinical study)
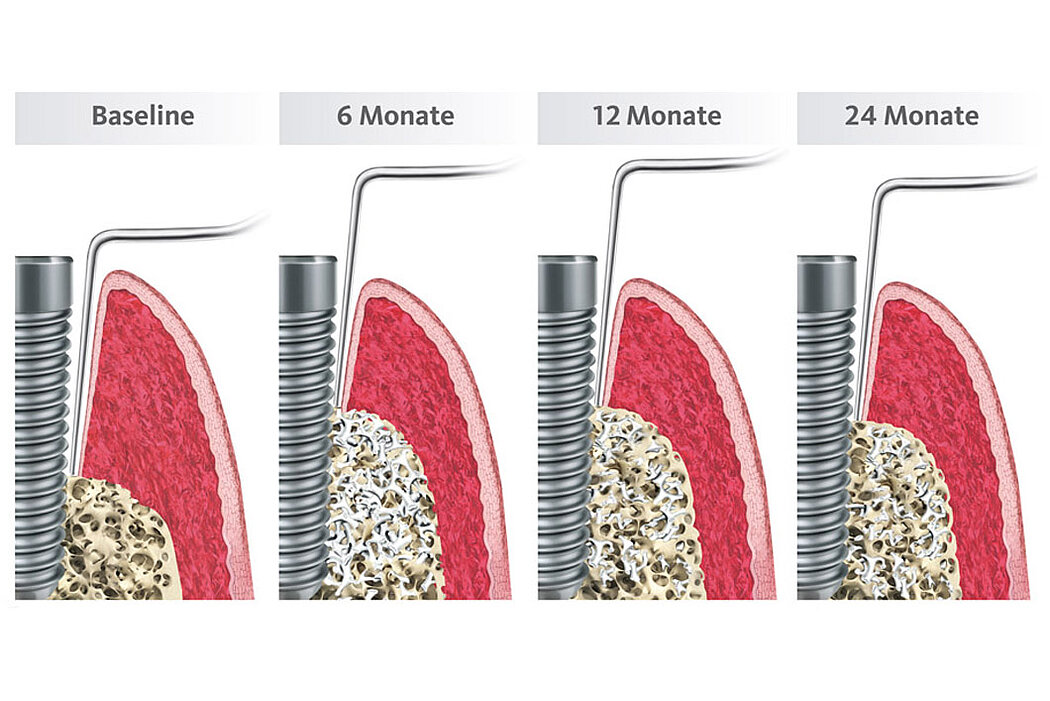
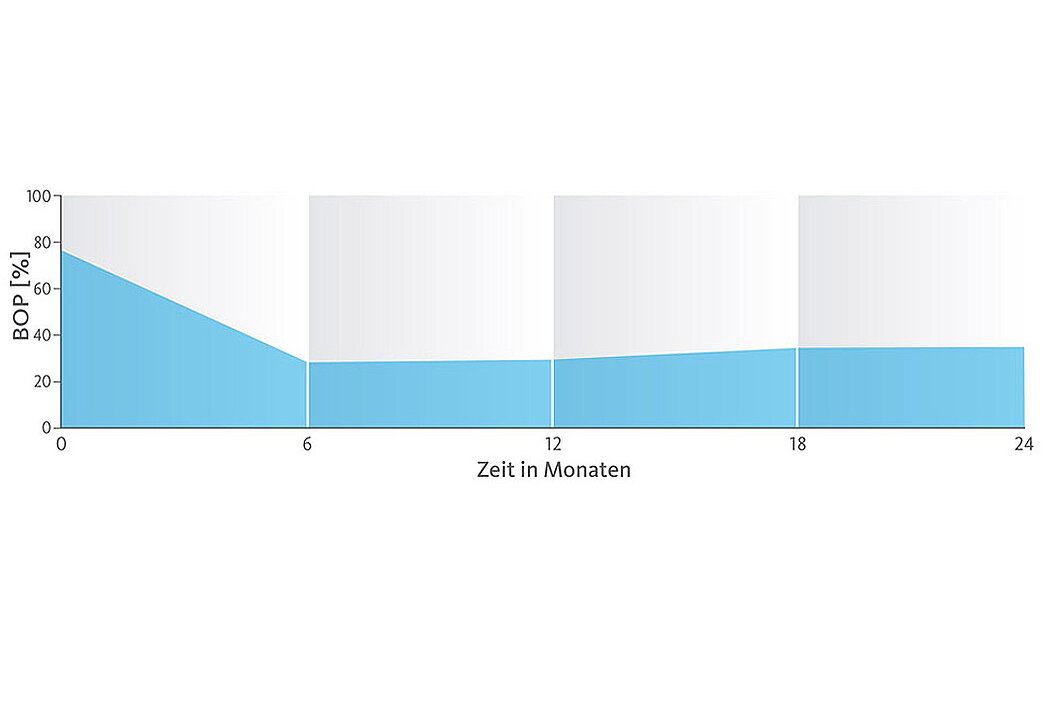
Die 2 Jahres-Daten zeigen, dass die ursprüngliche Sondierungstiefe bei 7,1 ± 0,8 mm auf 4,7 ± 0,7 mm verringert werden konnte und sich der Attachmentverlust von 7,5 ± 1,0 mm auf 5,5 ± 1,0 mm veränderte (Abb.4). Über den 24-monatigen Beobachtungszeitraum zeigte sich eine Reduktion der BOP-Werte von 78 % auf 34 % (s. Abb.).16,17
Unterschiedliche Studien weisen darauf hin, dass bei der Anwendung augmentativer Verfahren zur Defektauffüllung intraossärer Läsionen, die Verwendung xenogener Knochenersatzmaterialien boviner Herkunft mit einer Membran, zu besseren klinischen Resultaten führen als autogene Materialien oder alloplastische Augmentate ohne Barrieremembran.16,18
Geistlich Bio-Oss® Collagen zur Augmentation periimplantärer Knochendefekte
Die Verwendung von bovinem Knochenersatzmaterial in Kombination mit 10 % Kollagen, wie beispielsweise Geistlich Bio-Oss® Collagen, bietet die Option, komplexere Defekte durch die stabilisierende Eigenschaft des Kollagens zu versorgen. Auch Untersuchungen von Roccuzzo et al. konnten zeigen, dass bei Defekten der Klasse 1 (nach Schwarz et al. 2007) die Möglichkeit besteht, Periimplantitis-Läsionen erfolgreich mit der Verwendung von Geistlich Bio-Oss® Collagen zu behandeln. Die 1-Jahres-Daten zeigen, dass die Sondierungstiefe um 3 mm und die BOP-Werte um mehr als 70 % reduziert wurden.19
Therapieoptionen zum Erhalt des erkrankten Implantats
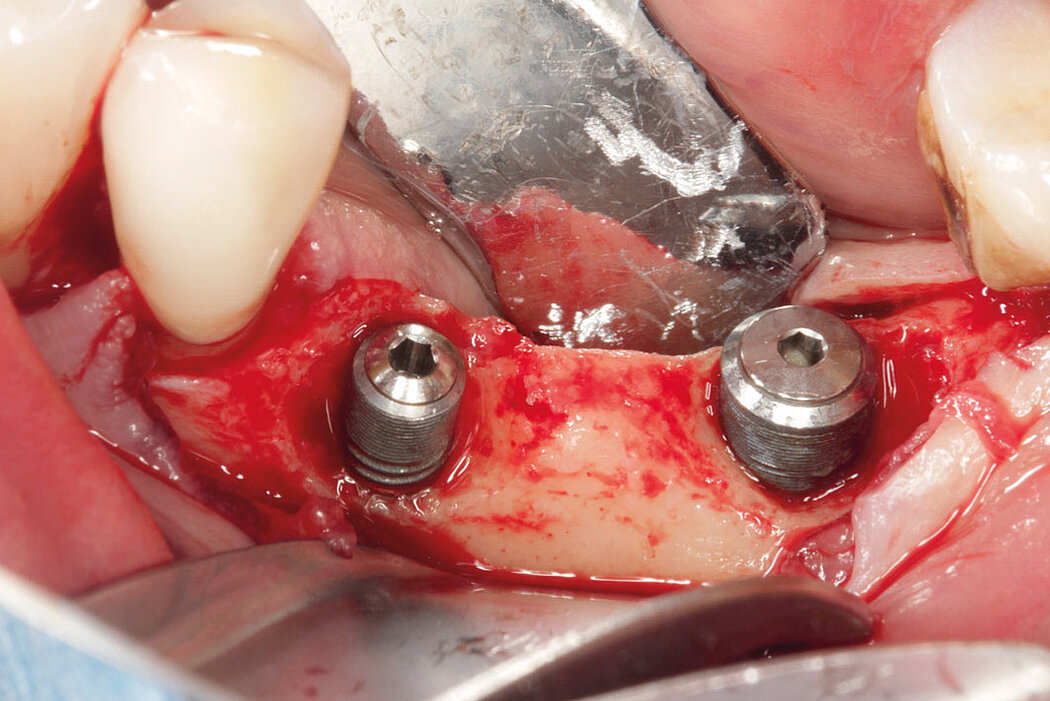
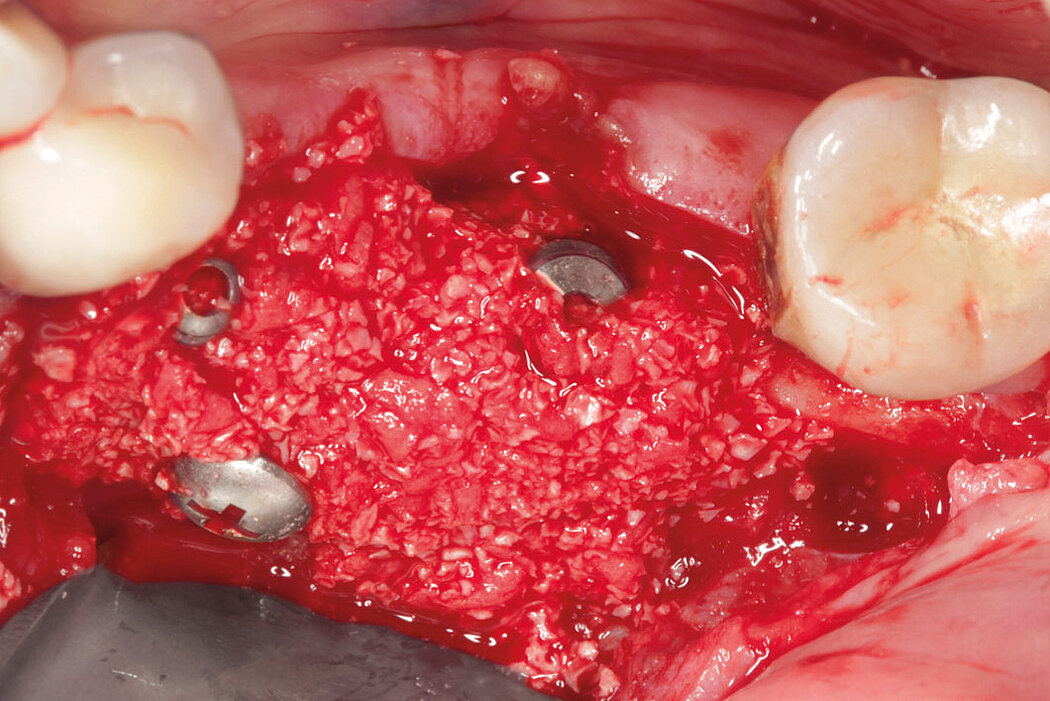
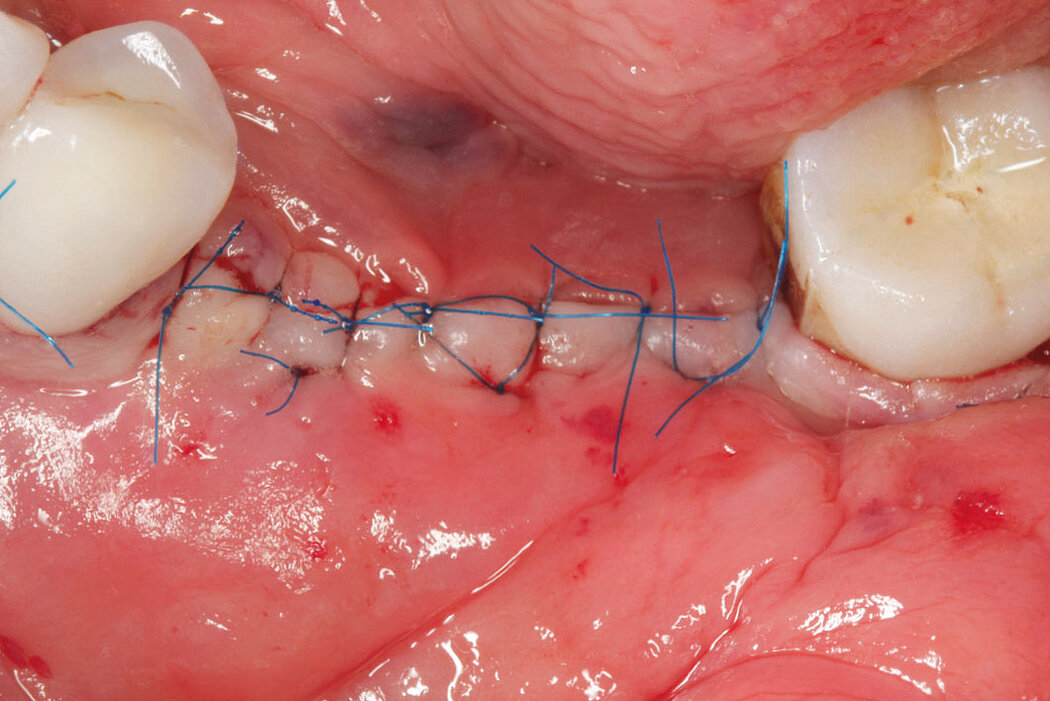
Ein durch eine Periimplantitis entstandener Knochendefekt sollte möglichst zeitnah nach der Diagnose behandelt werden, da diese Erkrankung sehr schnell und unberechenbar fortschreiten kann. Die Rekonstruktion des defekten Implantatlagers durch eine Augmentation mit Knochenersatzmaterial kann den Erhalt des Implantates sichern. Für eine erfolgreiche augmentative Versorgung des periimplantären Knochendefektes sind die Reinigung des Defektes und der Implantatoberfläche eine entscheidende Grundvoraussetzung. Hierzu zählen neben der Entfernung von Granulationsgewebe vor allem auch die Entfernung des Biofilms am Implantat, um erneute Infektionen zu verhindern.
Im Folgenden werden exemplarisch zwei Behandlungskonzepte der Implantatreinigung mit anschließender Augmentation mit Geistlich Biomaterialien vor-
gestellt.
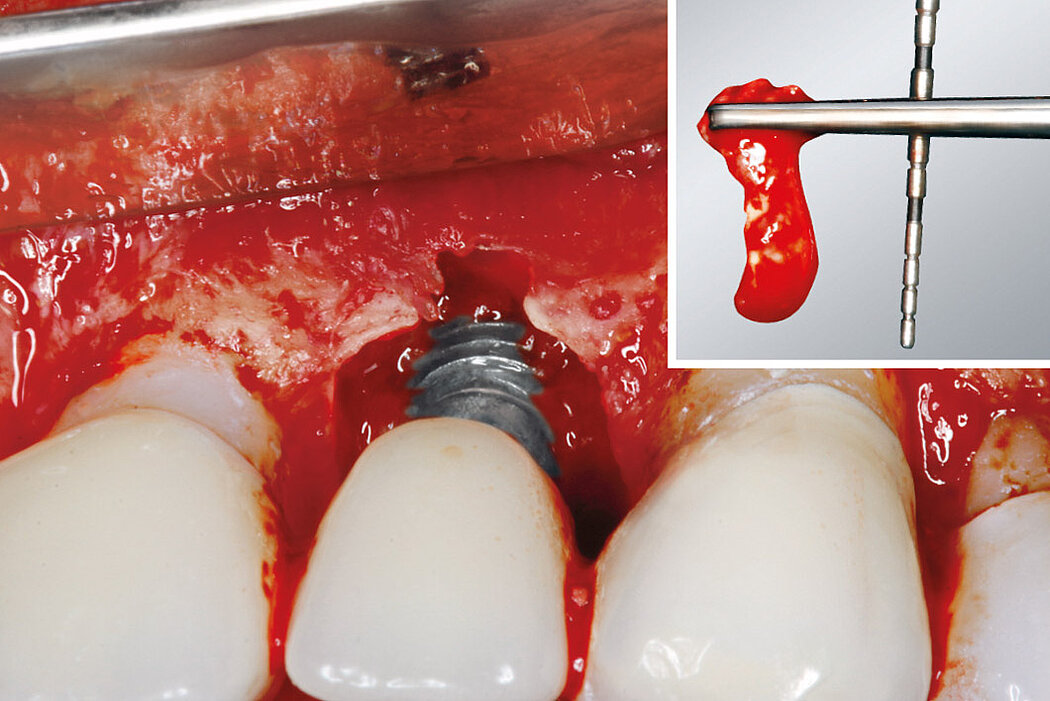
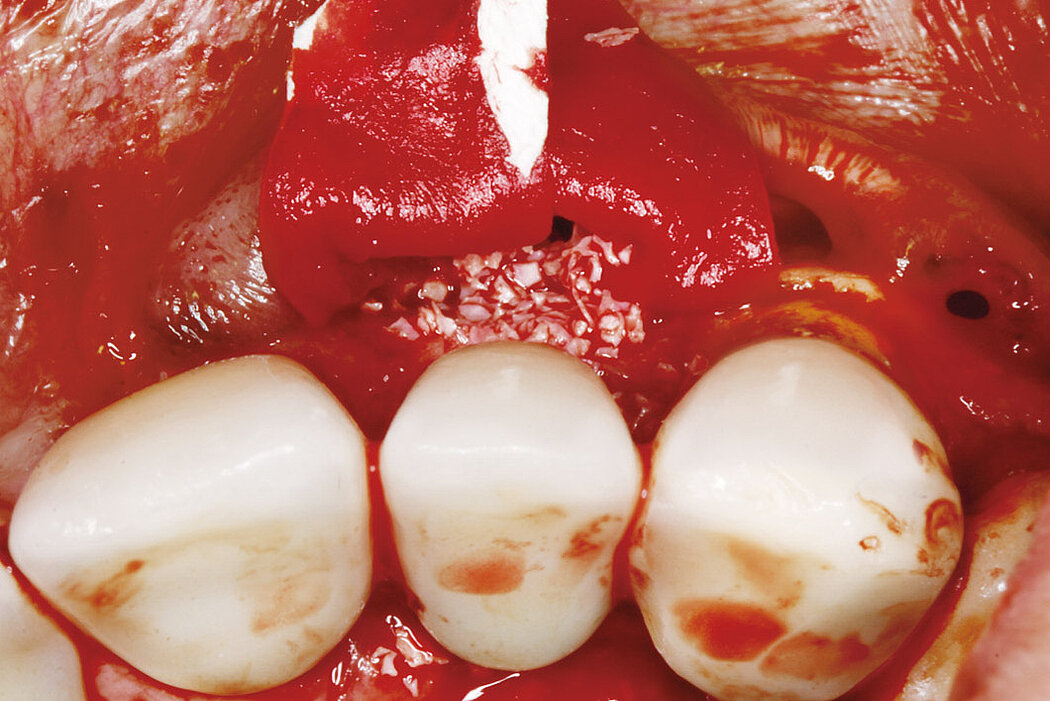
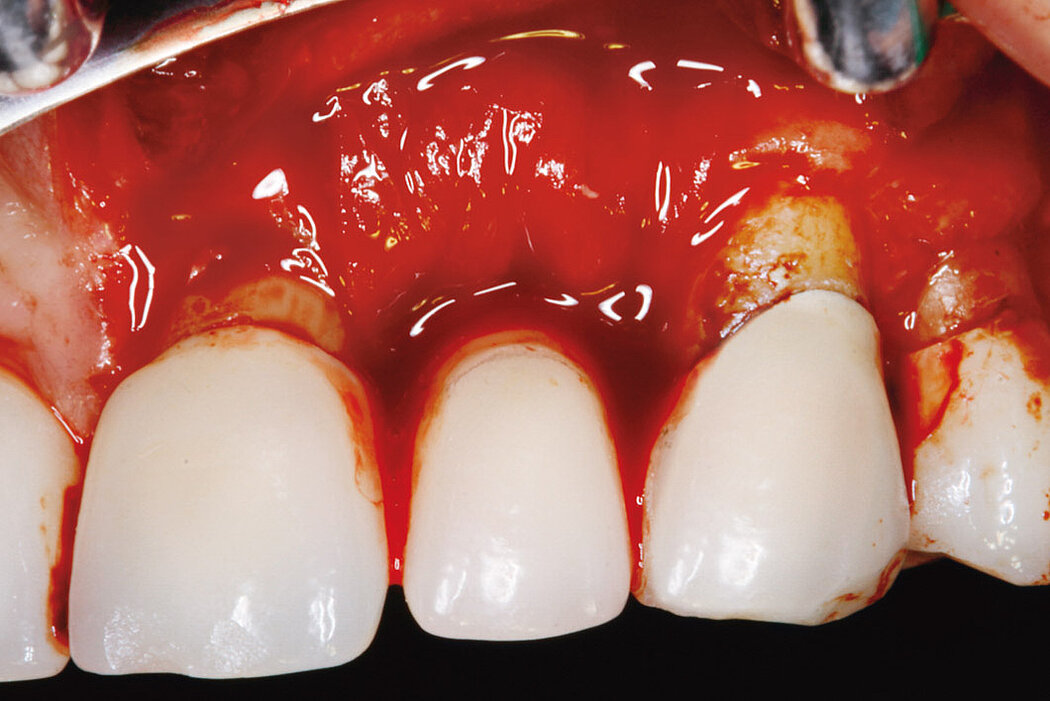
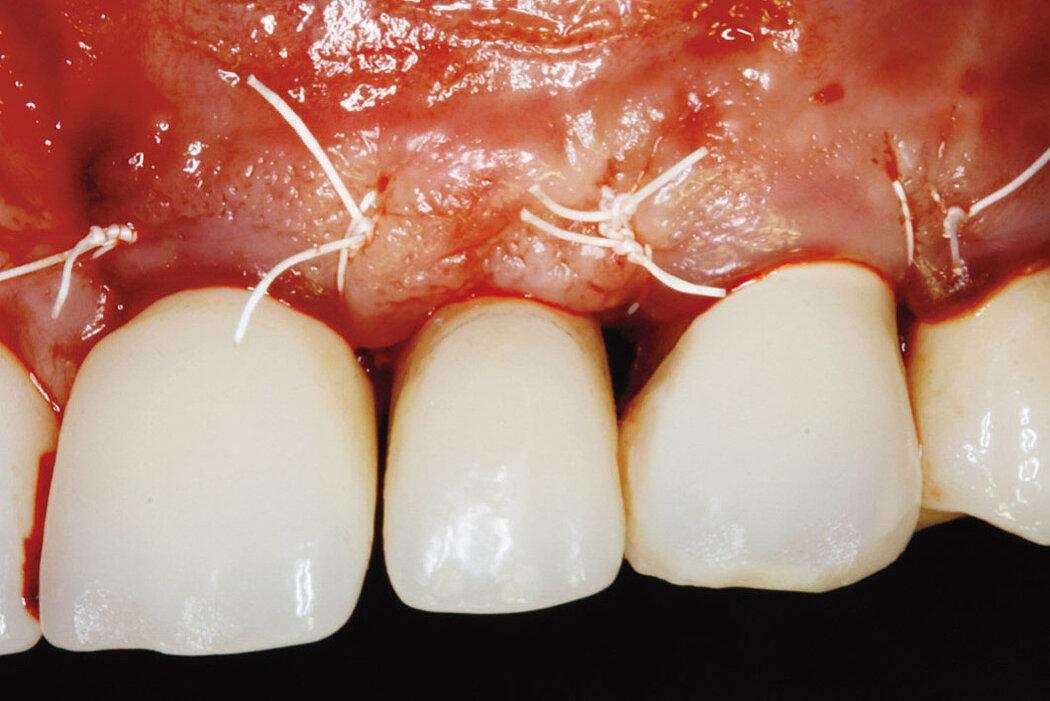
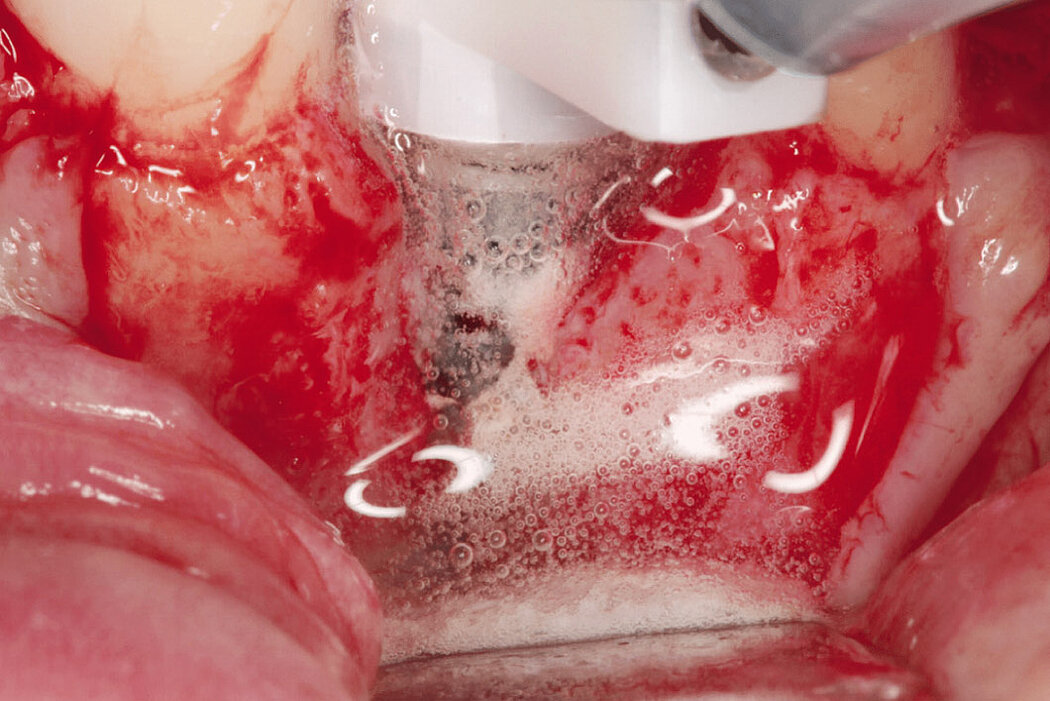
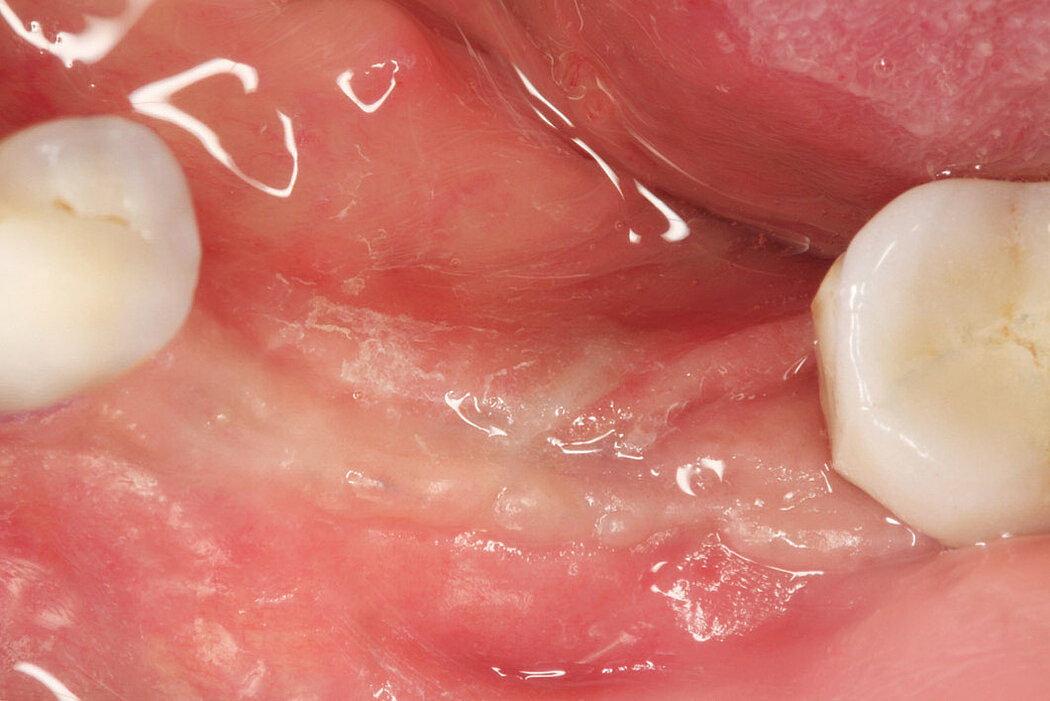
Aus der Praxis: Periimplantitis-Therapie mit Titanbürsten
Zur Reinigung der Implantatoberfläche stehen, wie bereits erwähnt, unterschiedliche Methoden und Hilfsmittel zur Verfügung. Häufig werden die von verschiedenen Herstellern angebotenen und in unterschiedlichen Designs und Größen verfügbaren Titanbürsten zur mechanischen Entfernung von entzündetem Granulationsgewebe und bakteriellen Belägen verwendet.
Referenzen
- Stein J M, Kämmerer P W. Periimplantäre Entzündungen – die Herausforderung unserer Zeit?. wissen kompakt 14, 1–2 (2020). (editorial)
- Berglundh T et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. Journal of periodontology vol. 89 Suppl 1 (2018): S313–S318. (consensus report)
- Froum S J et al. Peri-implant Mucositis. The International journal of periodontics & restorative dentistry vol. 39,2 (2019): e46–e57. (review)
- Lindhe J et al. Peri-implant diseases: Consensus Report of the Sixth European Workshop on Periodontology. Journal of clinical periodontology vol. 35,8 Suppl (2008): 282-5. (review)
- Serino G et al. Probing at implants with peri-implantitis and its relation to clinical peri-implant bone loss.Clinical oral implants research vol. 24,1 (2013): 91–5. (clinical study)
- Schwarz F, Becker L, AWMF. S3-Leitlinie: Die Behandlung periimplantärer Infektionen an Zahnimplantaten.AWMF (2016). (Leitlinie)
- Salvi G E, Ramseier C A. Efficacy of patient-administered mechanical and/or chemical plaque control protocols in the management of peri-implant mucositis. A systematic review. Journal of clinical periodontology vol.42 Suppl 16 (2014): S 187–201. (systematic review)
- Schwarz F, Becker J. Periimplantäre Infektionen. Ein Update zur Epidemiologie, Ätiologie, Diagnostik, Prävention und Therapie. Quintessenz Implantologie 23 (2015): 1–13. (Übersichtsartikel)
- Lang N P et al. Periimplant diseases: where are we now? –Consensus of the Seventh European Workshop on Periodontology. Journal of clinical periodontology vol. 38 Suppl 11 (2011): 178–81. (consensus report)
- Ratka C et al. The Effect of In Vitro Electrolytic Cleaning on Biofilm-Contaminated Implant Surfaces. Journal of clinical medicine vol. 8,9 1397. 6 Sep. 2019. (in vitro)
- Schlee M et al. Treatment of Peri-implantitis-Electrolytic Cleaning Versus Mechanical and Electrolytic Cleaning- A Randomized Controlled Clinical Trial-Six-Month Results. Journal of clinical medicine vol. 8,11 1909. 7Nov.2019. (in vitro)
- Schlee M et al. Is Complete Re-Osseointegration of an Infected Dental Implant Possible? Histologic Results of a Dog Study: A Short Communication. Journal of clinical medicine vol. 9,1 235. 16 Jan. 2020. (in vitro)
- Romeo E et al. Therapy of peri-implantitis with resective surgery. A 3-year clinical trial on rough screw-shaped oral implants. Part I: clinical outcome. Clinical oral implants research vol. 16,1 (2005): 9–18. (clinical case study)
- Meier R M et al. Surface quality after implantoplasty. Schweizer Monatsschrift für Zahnmedizin vol. 122,9 (2012): 714–24. (material scientific study)
- Monje A et al. Morphology and severity of peri-implantitis bone defects. Clinical implant dentistry and related research vol. 21,4 (2019): 635–643. (review)
- Schwarz F et al. Healing of intrabony peri-implantitis defects following application of a nanocrystalline hydroxyapatite (Ostim) or a bovine-derived xenograft (Bio-Oss) in combination with a collagen membrane (Bio-Gide). A case series. Journal of clinical periodontology vol. 33,7 (2006): 491–9. (clinical case series)
- Schwarz F et al. Two-year clinical results following treatment of peri-implantitis lesions using a nanocrystalline hydroxyapatite or a natural bone mineral in combination with a collagen membrane. Journal of clinical periodontology vol. 35,1 (2008): 80–7. (clinical case series)
- Aghazadeh A et al. A single-centre randomized controlled clinical trial on the adjunct treatment of intra-bony defects with autogenous bone or a xenograft: results after 12 months. Journal of clinical periodontology vol. 39,7 (2012): 666–73. (clinical case study)
- Roccuzzo M et al. Surgical therapy of single peri-implantitis intrabony defects, by means of deproteinized bovine bone mineral with 10% collagen. Journal of clinical periodontology vol. 43,3 (2016): 311-8. (clinical study)
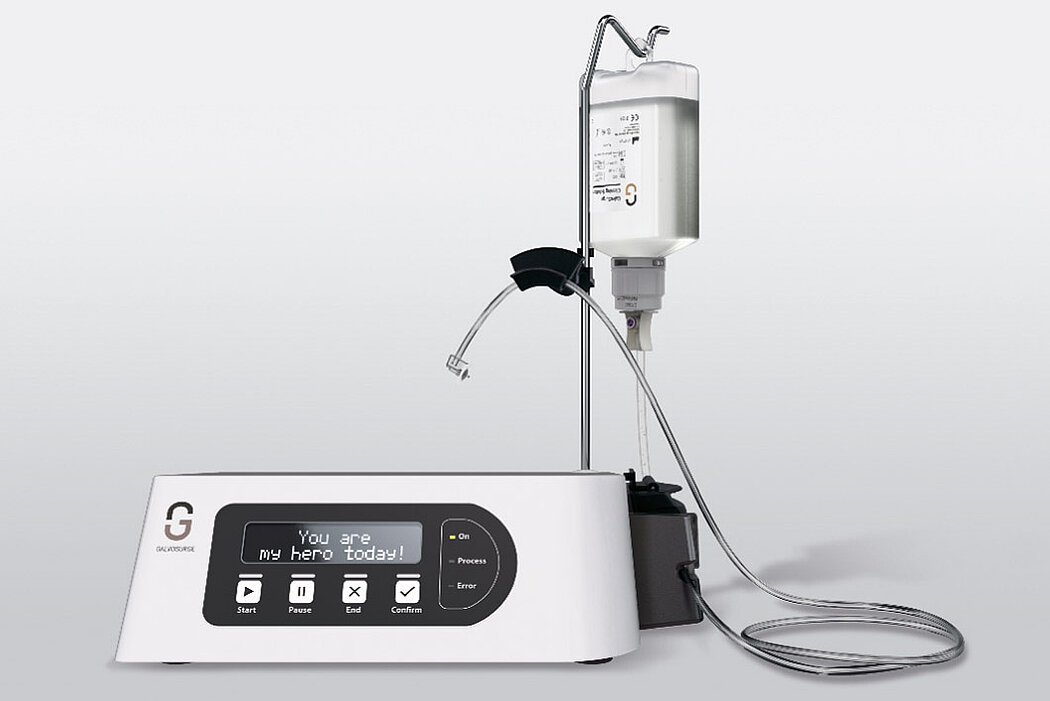
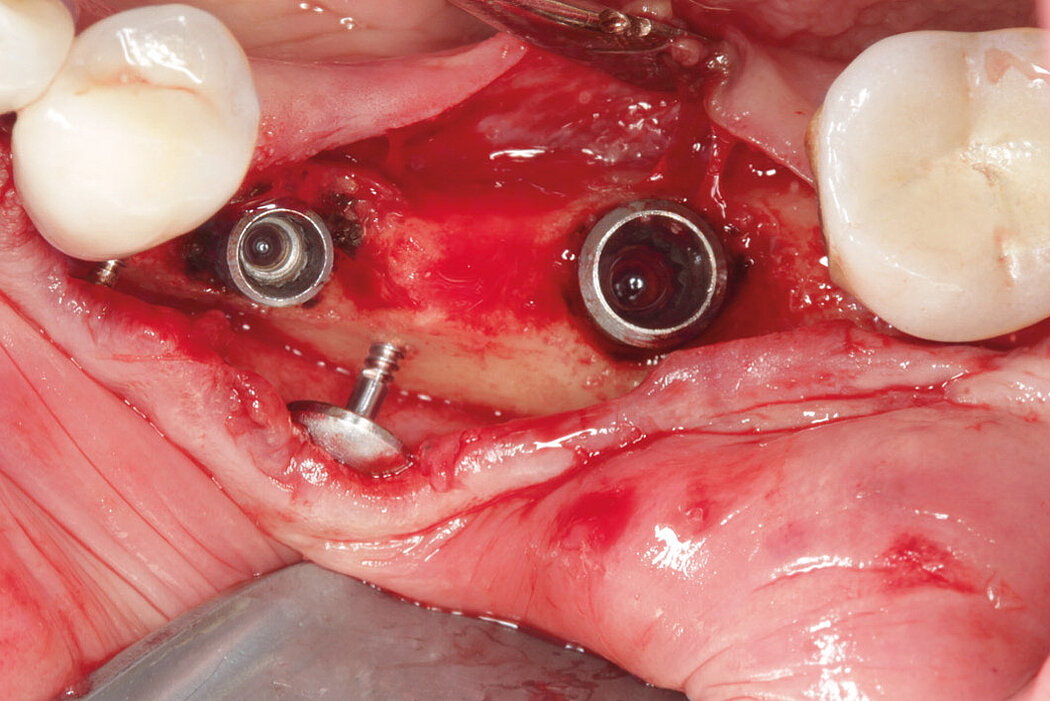
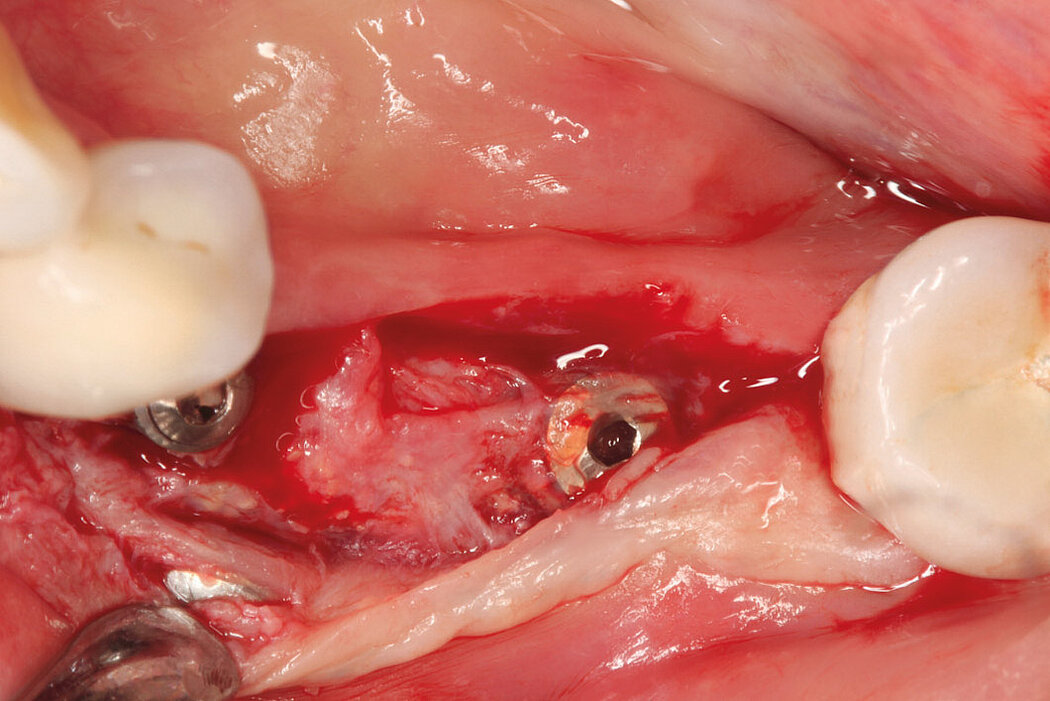
Aus der Praxis: Periimplantitis-Therapie mit GalvoSurge®
Zur Reinigung der Implantatoberfläche stehen, wie bereits erwähnt, unterschiedliche Methoden und Hilfsmittel zur Verfügung. Häufig werden die von verschiedenen Herstellern angebotenen und in unterschiedlichen Designs und Größen verfügbaren Titanbürsten zur mechanischen Entfernung von entzündetem Granulationsgewebe und bakteriellen Belägen verwendet.
GalvoSurge® ist eine elektrolytische Reinigungsmethode zur Biofilmentfernung an osseointegrierten, elektrisch leitfähigen Implantaten, ohne die Implantatoberfläche zu beschädigen. Da mit dieser Methode der Biofilm komplett vom Implantat entfernt wird, lässt sich mit einer ergänzenden regenerativen Therapie eine Re-Osseointegration des Implantates erreichen.
Wirkungsprinzip GalvoSurge®
Das Prinzip beruht auf einer geringgradigen, an das Implantat angelegten elektrischen Spannung und dem Besprühen des Implantats mit einer Reinigungsflüssigkeit. Das führt zu einer hydrolytischen Spaltung von Wasser in H+ und OH-Ionen. Die positiv geladenen Wasserstoffionen (H+) penetrieren den Biofilm und nehmen von der negativ geladenen Implantatoberfläche je ein Elektron auf. Es entsteht atomarer Wasserstoff, der sich zu H2 kumuliert. Wasserstoffbläschen heben den Biofilm samt Stoffwechselprodukten und Kohlenwasserstoffen von der Implantatoberfläche ab.10,11
- Stein J M, Kämmerer P W. Periimplantäre Entzündungen – die Herausforderung unserer Zeit?. wissen kompakt 14, 1–2 (2020). (editorial)
- Berglundh T et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. Journal of periodontology vol. 89 Suppl 1 (2018): S313–S318. (consensus report)
- Froum S J et al. Peri-implant Mucositis. The International journal of periodontics & restorative dentistry vol. 39,2 (2019): e46–e57. (review)
- Lindhe J et al. Peri-implant diseases: Consensus Report of the Sixth European Workshop on Periodontology. Journal of clinical periodontology vol. 35,8 Suppl (2008): 282-5. (review)
- Serino G et al. Probing at implants with peri-implantitis and its relation to clinical peri-implant bone loss.Clinical oral implants research vol. 24,1 (2013): 91–5. (clinical study)
- Schwarz F, Becker L, AWMF. S3-Leitlinie: Die Behandlung periimplantärer Infektionen an Zahnimplantaten.AWMF (2016). (Leitlinie)
- Salvi G E, Ramseier C A. Efficacy of patient-administered mechanical and/or chemical plaque control protocols in the management of peri-implant mucositis. A systematic review. Journal of clinical periodontology vol.42 Suppl 16 (2014): S 187–201. (systematic review)
- Schwarz F, Becker J. Periimplantäre Infektionen. Ein Update zur Epidemiologie, Ätiologie, Diagnostik, Prävention und Therapie. Quintessenz Implantologie 23 (2015): 1–13. (Übersichtsartikel)
- Lang N P et al. Periimplant diseases: where are we now? –Consensus of the Seventh European Workshop on Periodontology. Journal of clinical periodontology vol. 38 Suppl 11 (2011): 178–81. (consensus report)
- Ratka C et al. The Effect of In Vitro Electrolytic Cleaning on Biofilm-Contaminated Implant Surfaces. Journal of clinical medicine vol. 8,9 1397. 6 Sep. 2019. (in vitro)
- Schlee M et al. Treatment of Peri-implantitis-Electrolytic Cleaning Versus Mechanical and Electrolytic Cleaning- A Randomized Controlled Clinical Trial-Six-Month Results. Journal of clinical medicine vol. 8,11 1909. 7Nov.2019. (in vitro)
- Schlee M et al. Is Complete Re-Osseointegration of an Infected Dental Implant Possible? Histologic Results of a Dog Study: A Short Communication. Journal of clinical medicine vol. 9,1 235. 16 Jan. 2020. (in vitro)
- Romeo E et al. Therapy of peri-implantitis with resective surgery. A 3-year clinical trial on rough screw-shaped oral implants. Part I: clinical outcome. Clinical oral implants research vol. 16,1 (2005): 9–18. (clinical case study)
- Meier R M et al. Surface quality after implantoplasty. Schweizer Monatsschrift für Zahnmedizin vol. 122,9 (2012): 714–24. (material scientific study)
- Monje A et al. Morphology and severity of peri-implantitis bone defects. Clinical implant dentistry and related research vol. 21,4 (2019): 635–643. (review)
- Schwarz F et al. Healing of intrabony peri-implantitis defects following application of a nanocrystalline hydroxyapatite (Ostim) or a bovine-derived xenograft (Bio-Oss) in combination with a collagen membrane (Bio-Gide). A case series. Journal of clinical periodontology vol. 33,7 (2006): 491–9. (clinical case series)
- Schwarz F et al. Two-year clinical results following treatment of peri-implantitis lesions using a nanocrystalline hydroxyapatite or a natural bone mineral in combination with a collagen membrane. Journal of clinical periodontology vol. 35,1 (2008): 80–7. (clinical case series)
- Aghazadeh A et al. A single-centre randomized controlled clinical trial on the adjunct treatment of intra-bony defects with autogenous bone or a xenograft: results after 12 months. Journal of clinical periodontology vol. 39,7 (2012): 666–73. (clinical case study)
- Roccuzzo M et al. Surgical therapy of single peri-implantitis intrabony defects, by means of deproteinized bovine bone mineral with 10% collagen. Journal of clinical periodontology vol. 43,3 (2016): 311-8. (clinical study)
Fallbilder Periimplantitis-Therapie mit Titanbürsten mit freundlicher Genehmigung von ©K.Obreja, F. Schwarz; alle Rechte vorbehalten.
Fallbilder Periimplantitis-Therapie mit GalvoSurge® mit freundlicher Genehmigung von PD Dr. Dr.Markus Schlee und Dr. Florian Rathe MSc.