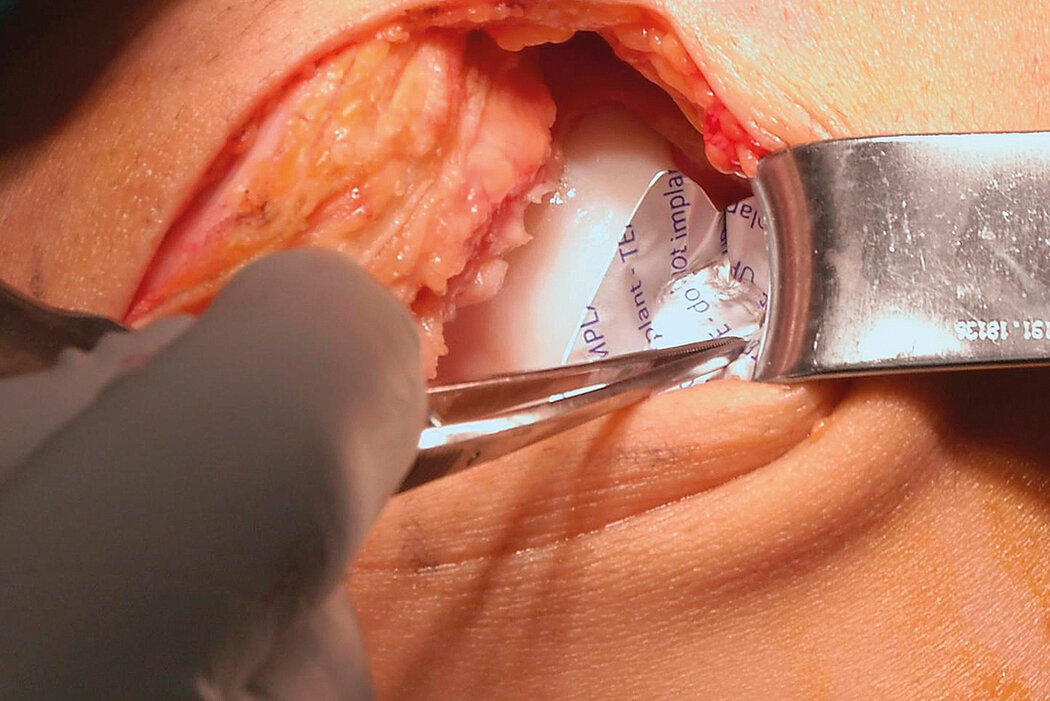
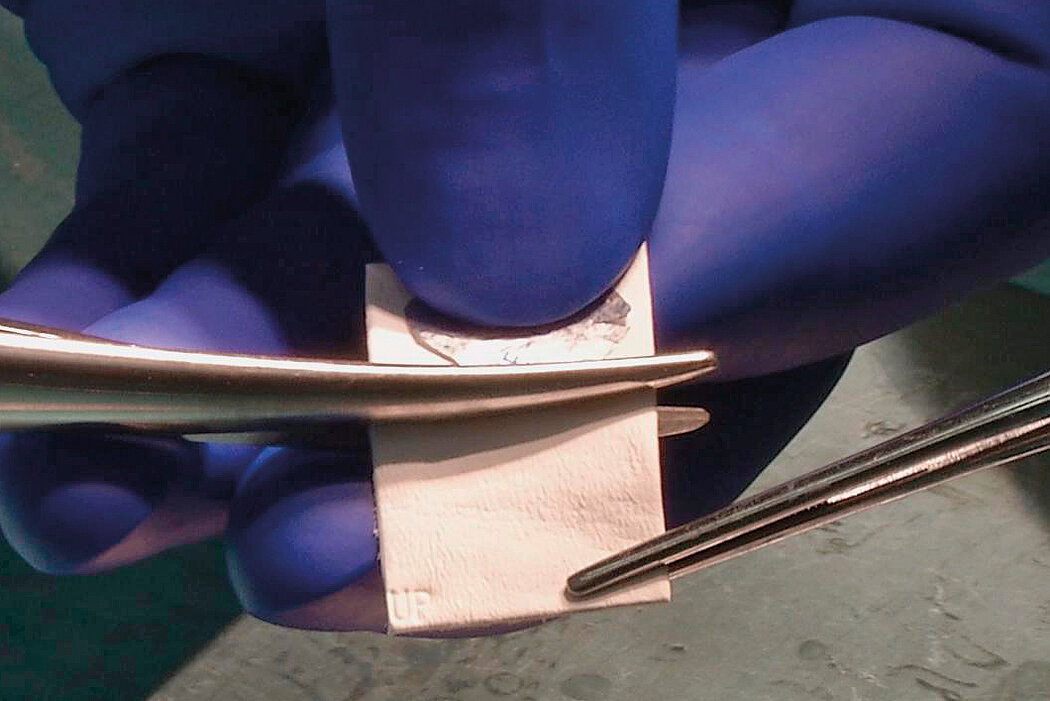
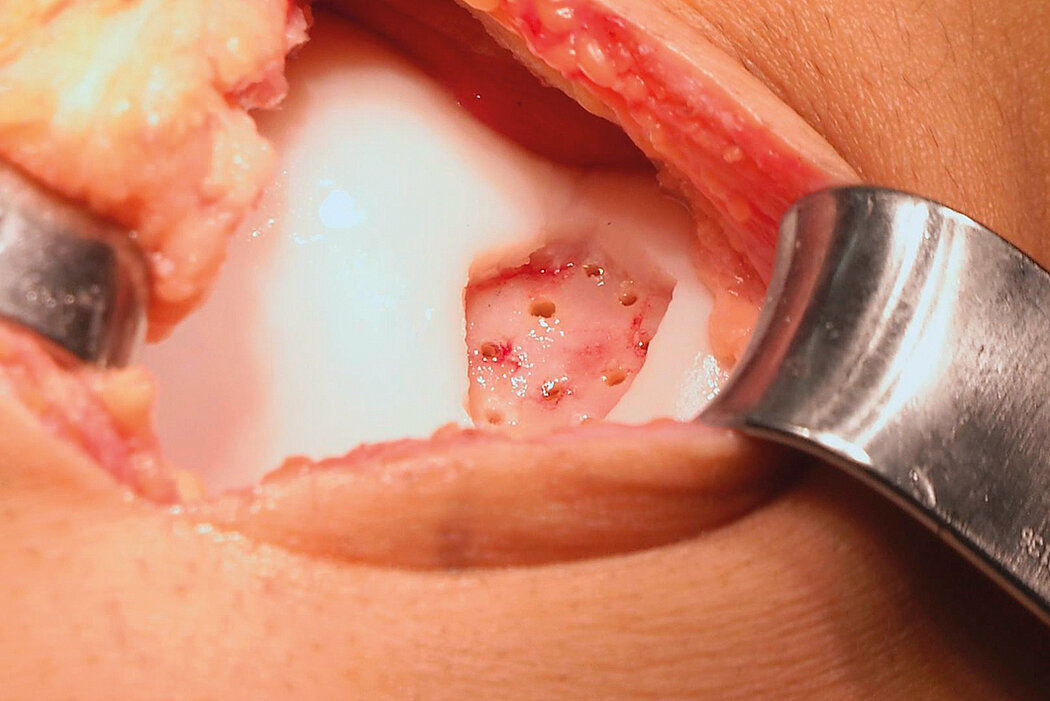
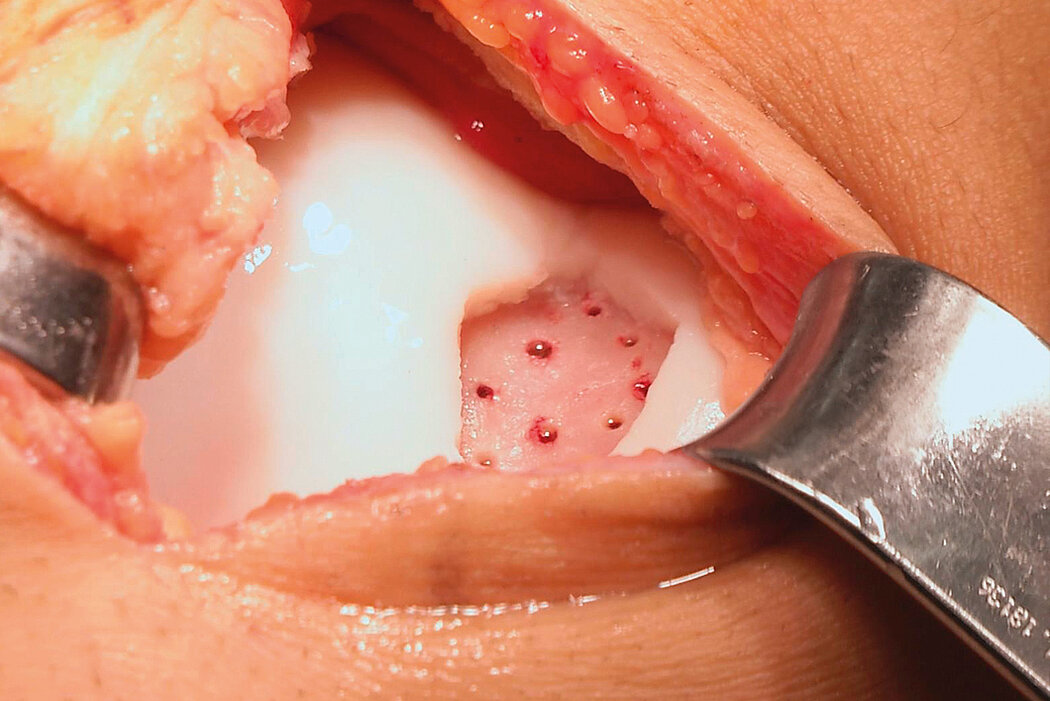
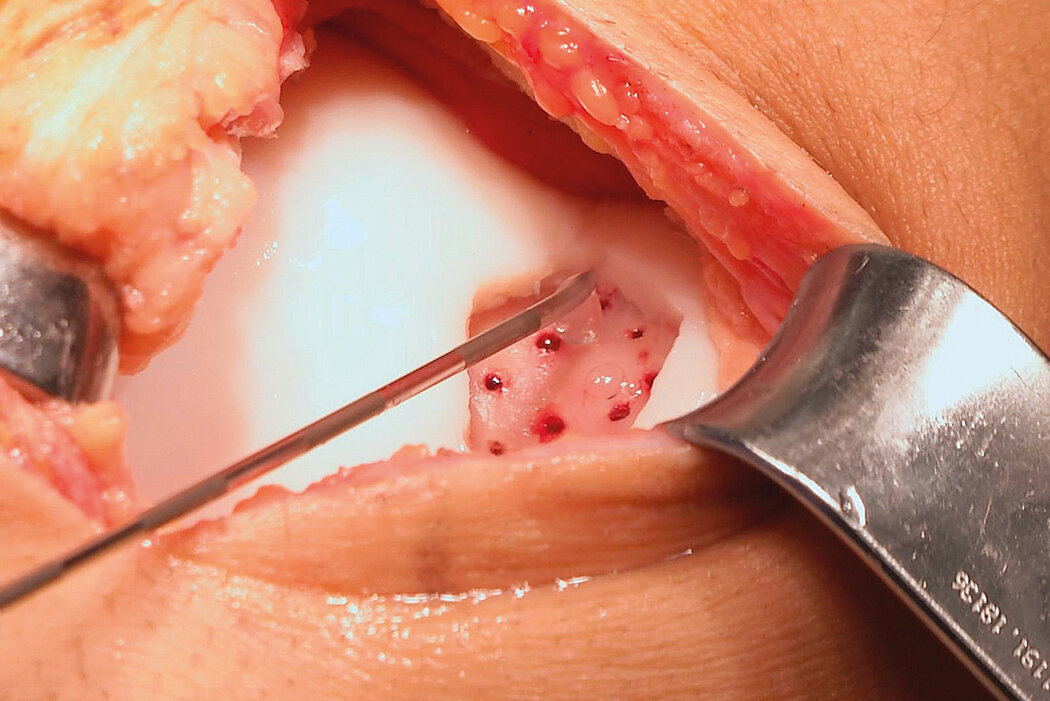
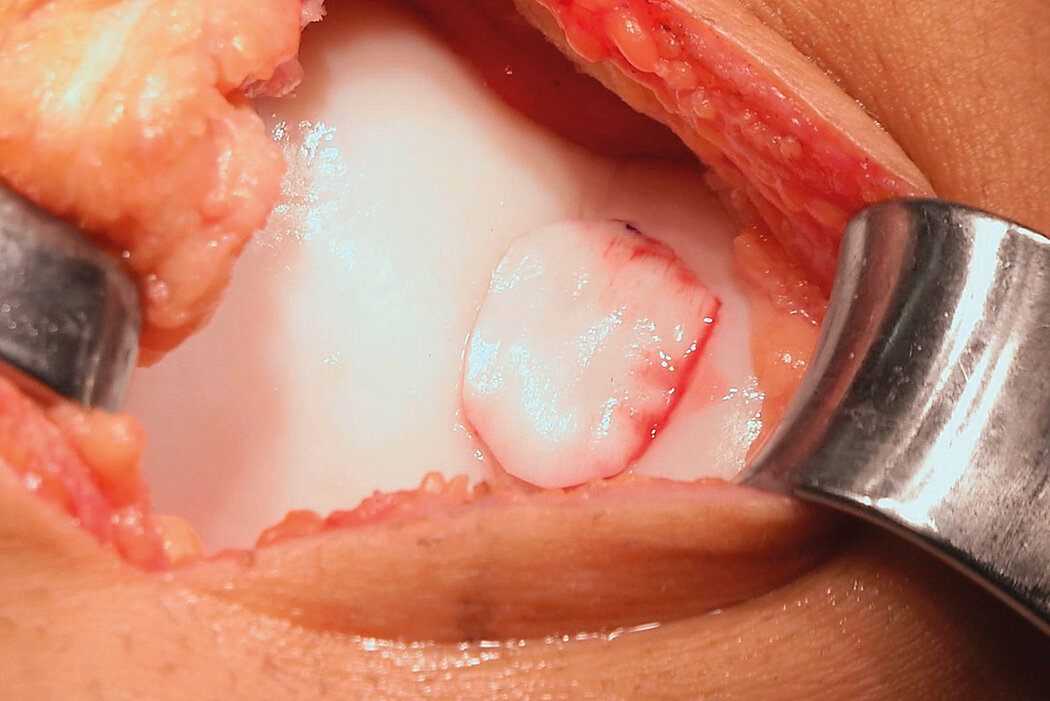
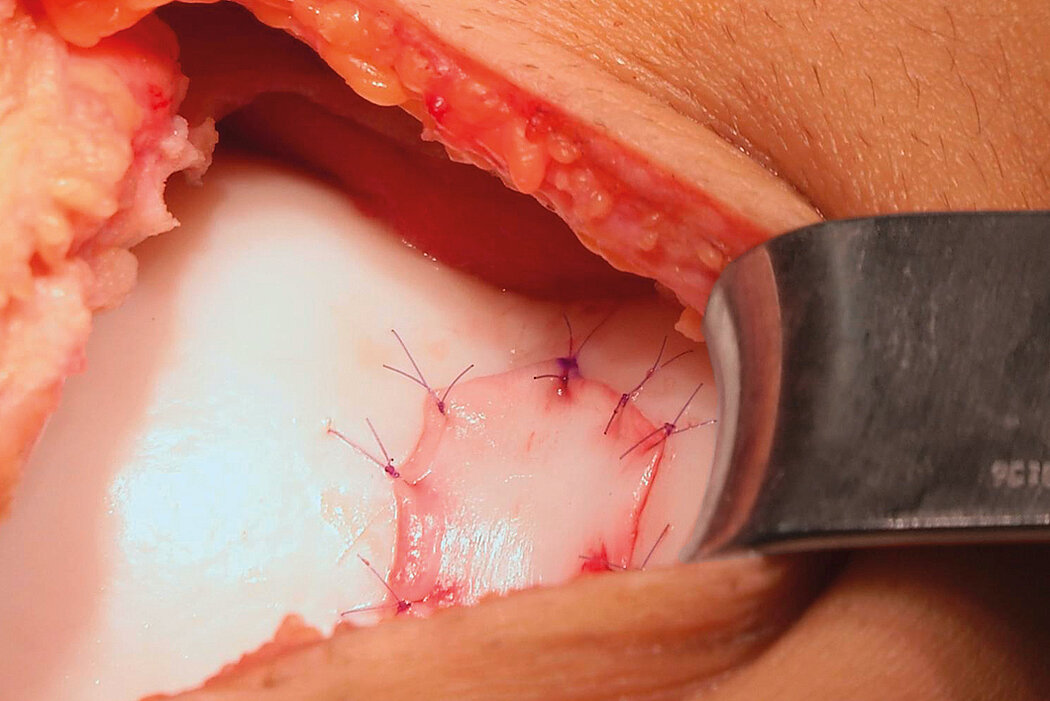
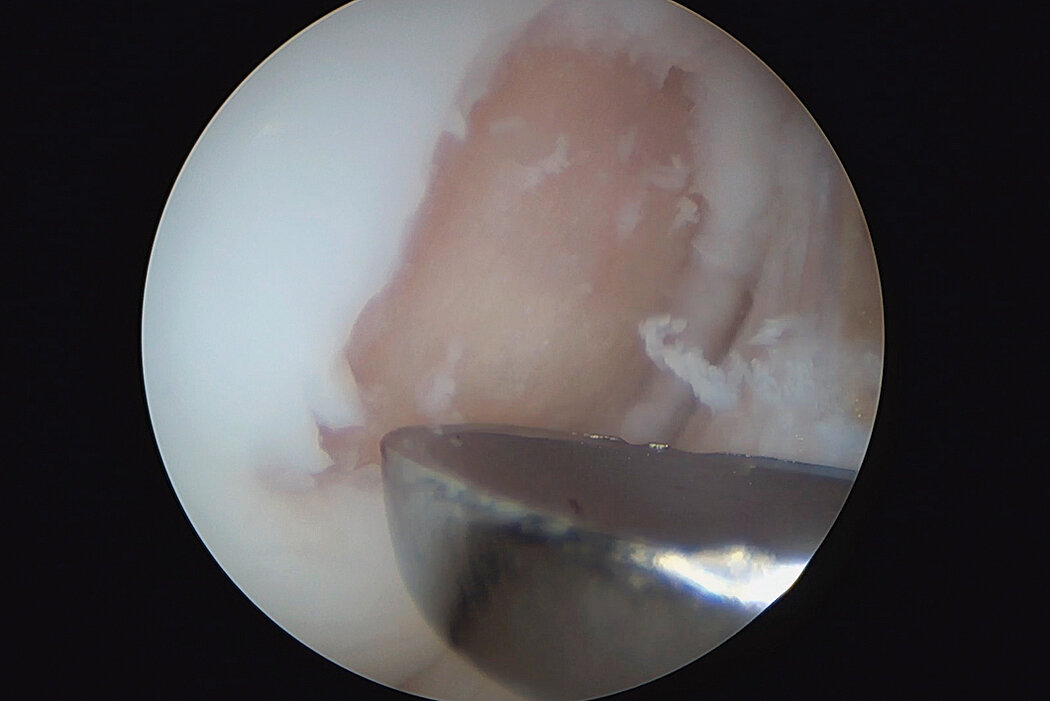
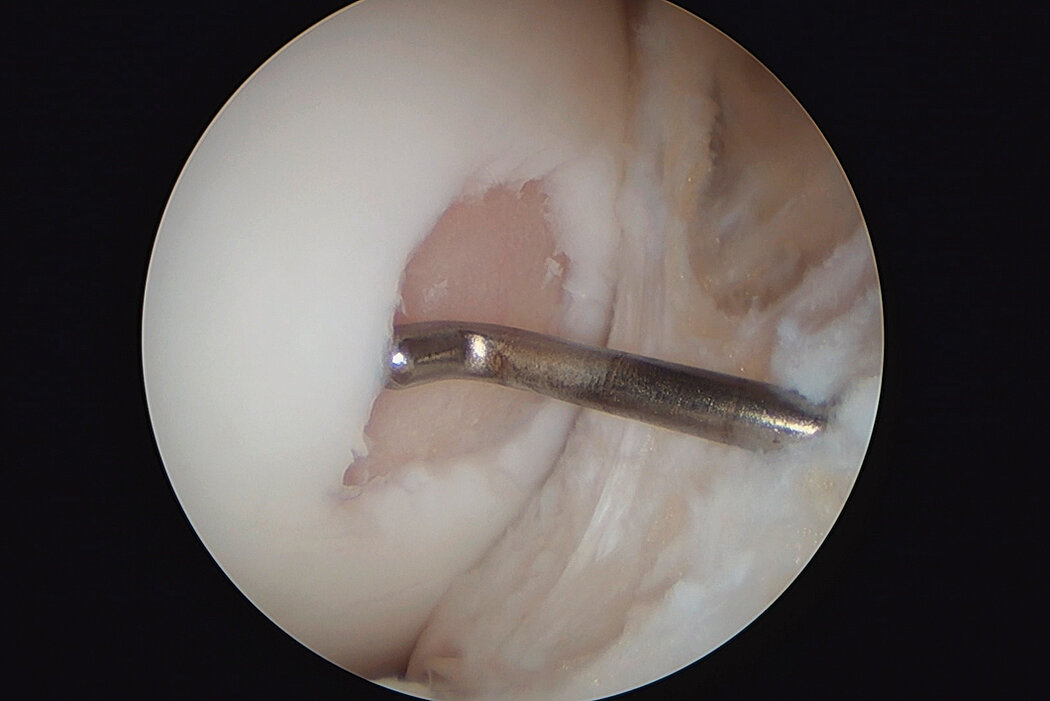
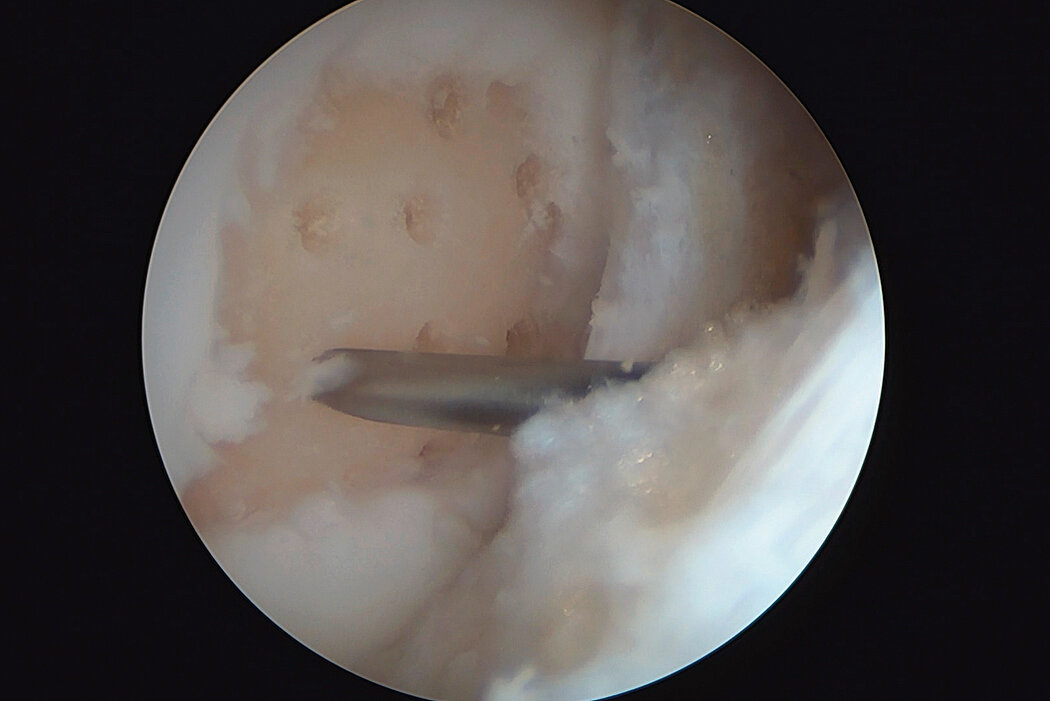
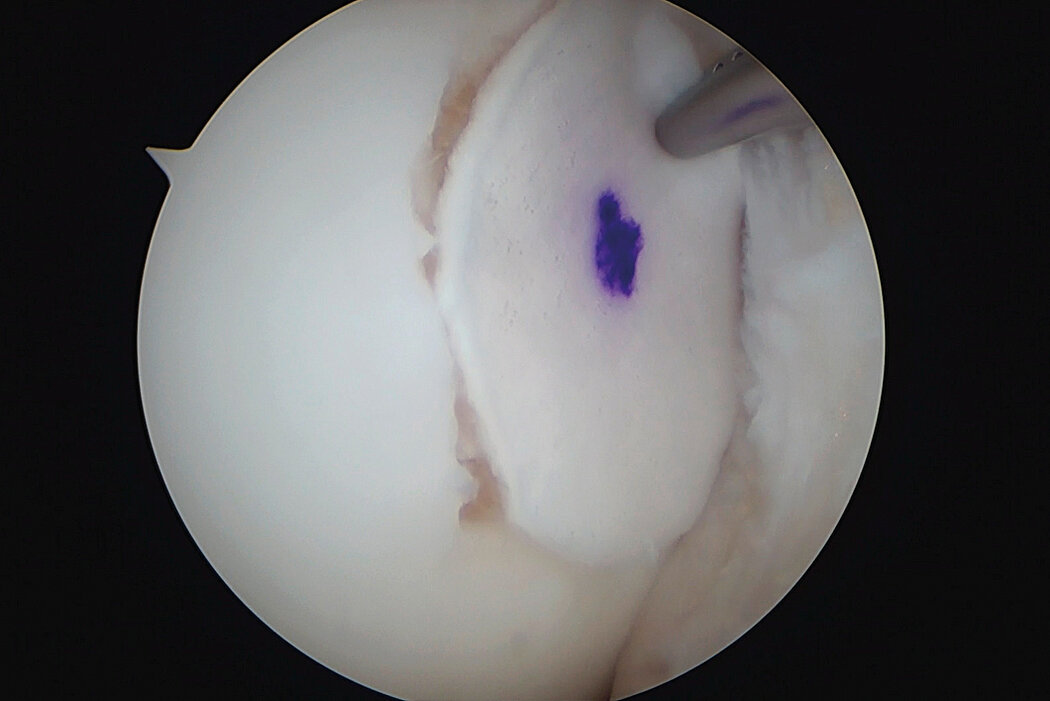
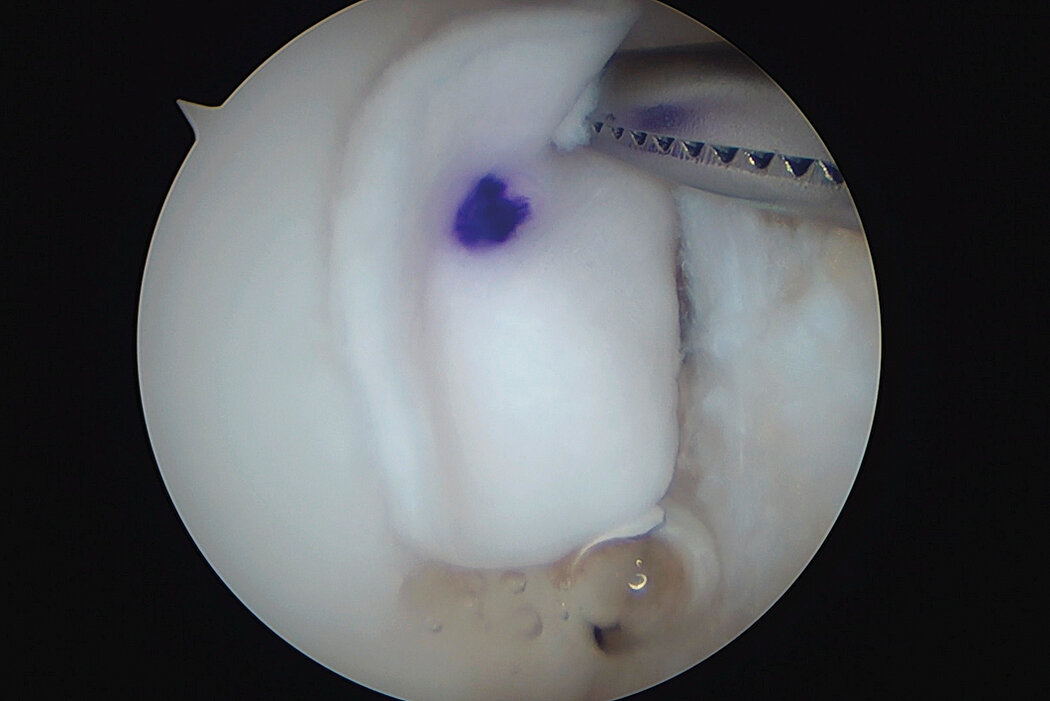
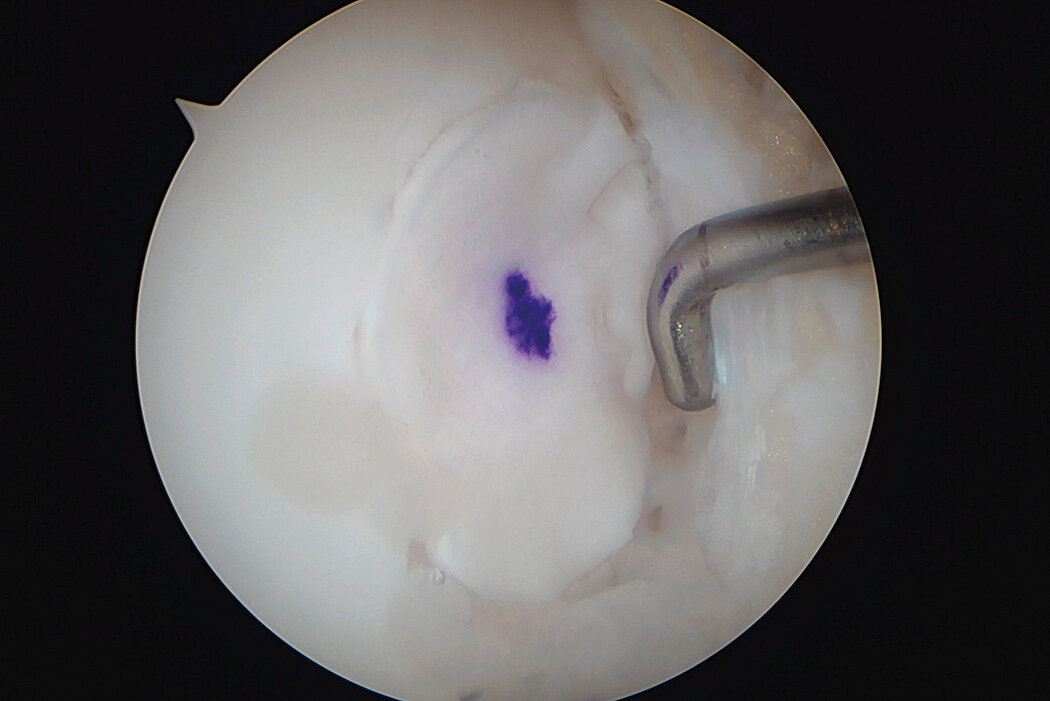
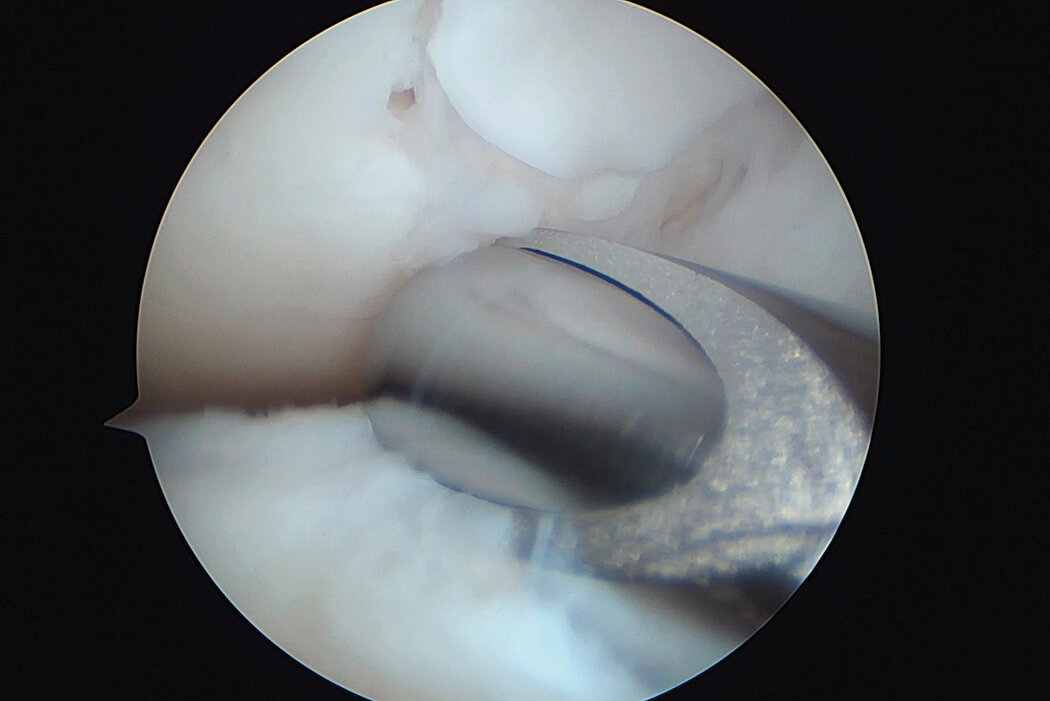
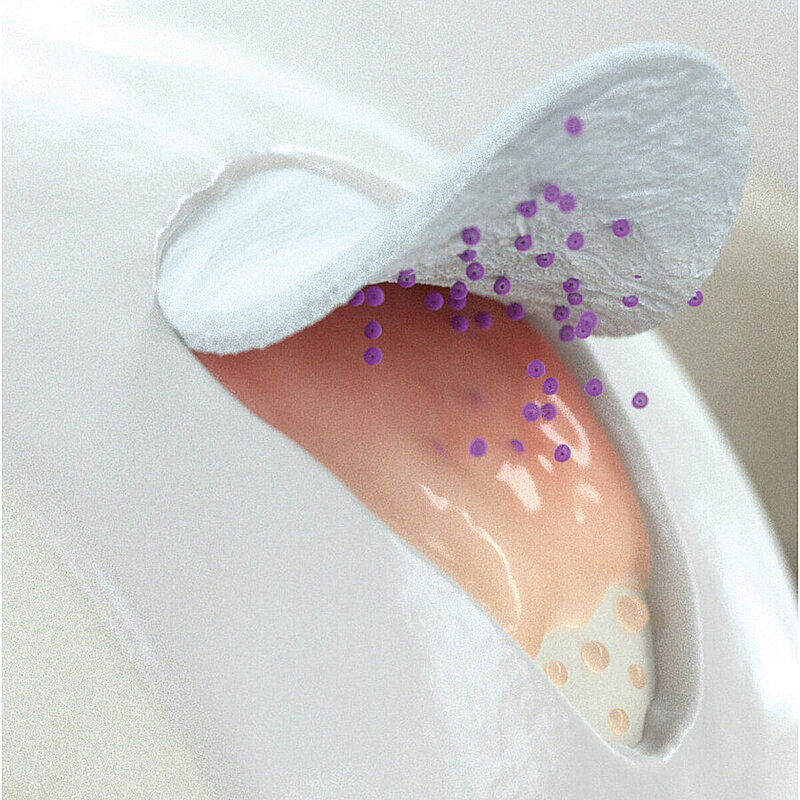
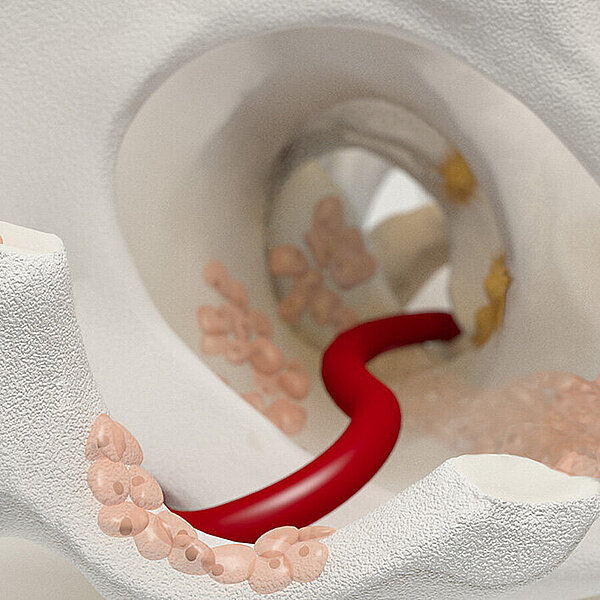
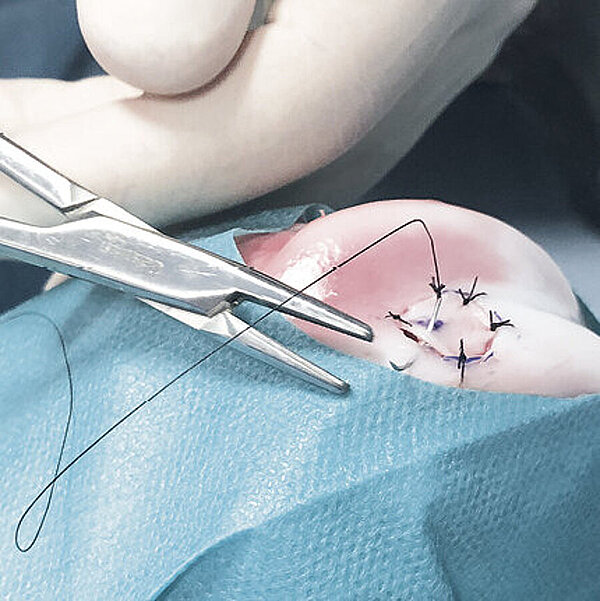
AMIC® Chondro-Gide® im Knie
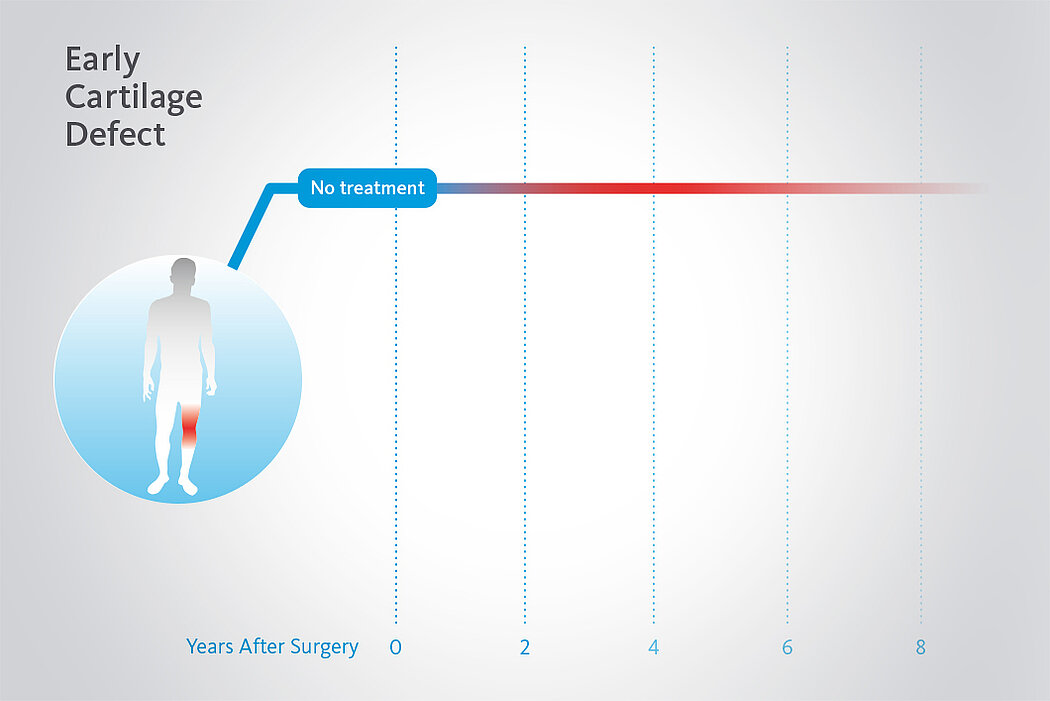
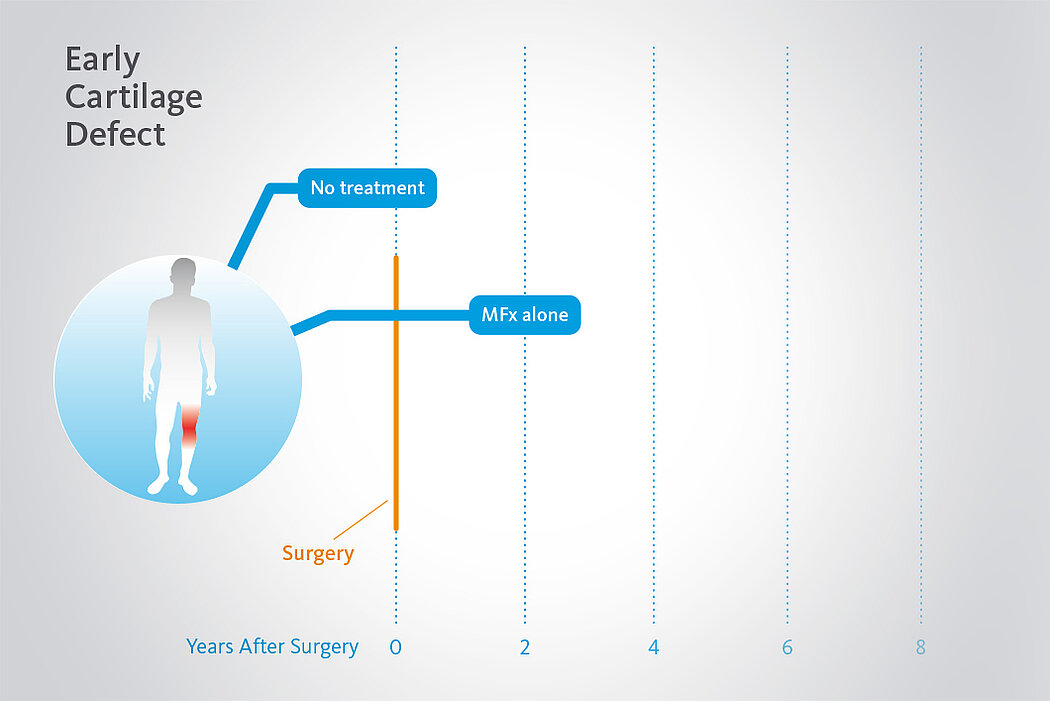
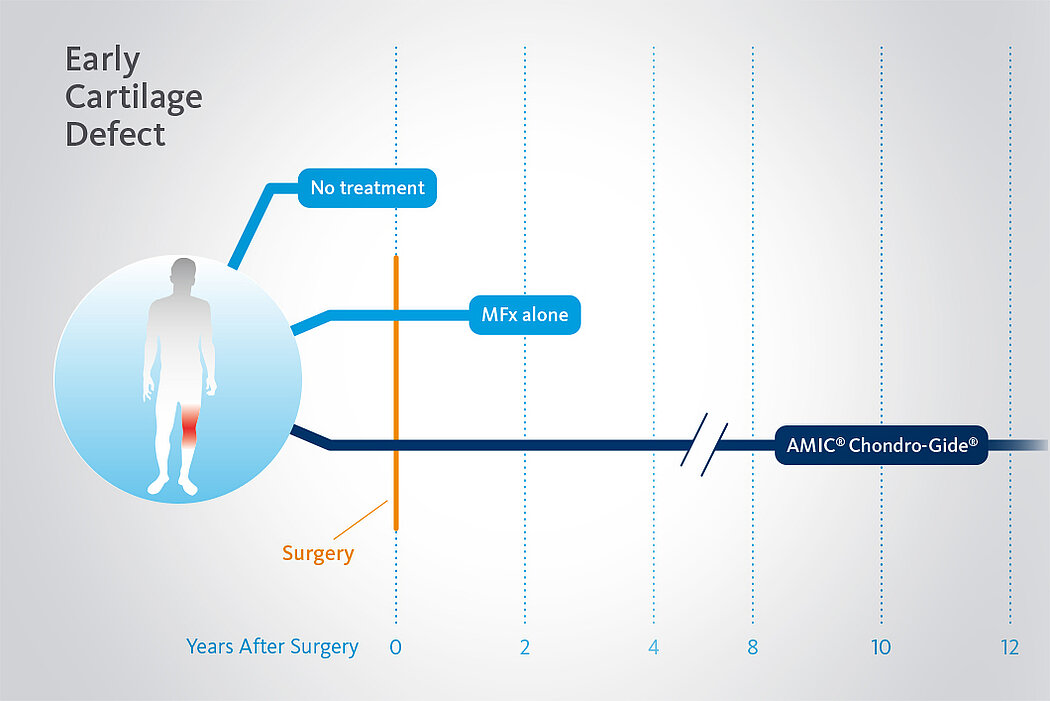
AMIC® Chondro-Gide® ist ein minimalinvasives, einzeitiges Verfahren, das Autologe Matrixinduzierte Chondrogenese (AMIC®) in Kombination mit Chondro-Gide® nutzt, um defekten Knorpel jeder Grösse zu reparieren. Getragen von über zehn Jahren klinischem Erfolg ist AMIC® Chondro-Gide® eine effektive und kostengünstige Behandlung1,2,3 zur Reparatur von beschädigtem Knieknorpel, zur Schmerzprophylaxe und -linderung sowie zur Verlangsamung des Knorpelabbaus.
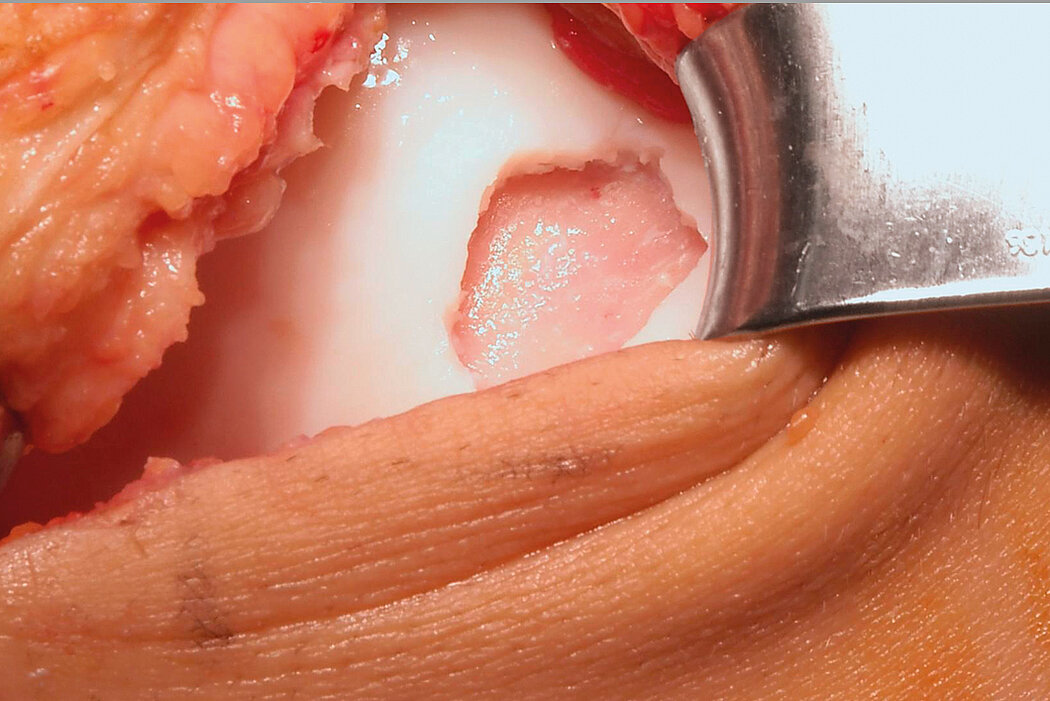
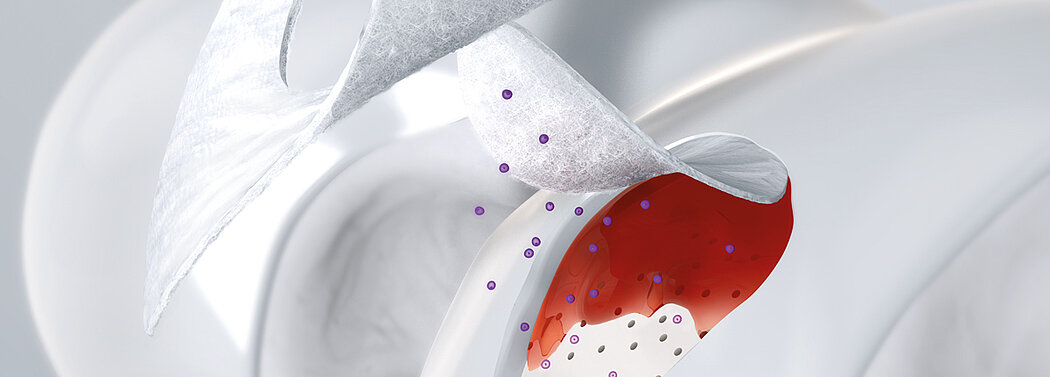
AMIC® Chondro-Gide® kombiniert Mikrofrakturierung (MFx) mit dem Einsatz von Chondro-Gide®. So wird der Superthrombus, der durch die MFx erfolgt, ebenso bedeckt und geschützt wie das Reparaturgewebe.4 Die Technik kann als Mini-open-Verfahren oder arthroskopisch durchgeführt werden. Chondro-Gide® ist biokompatibel, wird vollständig resorbiert und unterstützt das Selbstheilungspotenzial des Körpers.
Vorteile
Mit seiner speziell entwickelten Bilayer-Struktur bietet Chondro-Gide® ein schützendes Umfeld, welches das Wachstum von neuem Knorpel unterstützt.5,6
- Biotechnisch gewonnene, Bilayer Kollagen I/III Membran5
- Biokompatibel und natürlich resorbierbar5
- Einfache Handhabung – biegsam und reissfest5
- Kann geklebt oder genäht werden5
- Kompatibel mit verschiedenen Gewebe-Regenerationstechniken7
- Einzeitiges Verfahren5
- Jederzeit verfügbar und einsatzbereit
References
- SCHIAVONE PANNI, A., et al. Good clinical results with autologous matrix-induced chondrogenesis (Amic) technique in large knee chondral defects. Knee Surg Sports Traumatol Arthrosc, 2018 Apr 26(4):1130-36 (Clinical study)
- WALTHER, M., et al. Scaffold based reconstruction of focal full thickness talar cartilage defects. Clinical Research on Foot & Ankle, 2013, 1-5. (Clinical study)
- KAISER, N., et al. Clinical results 10 years after AMIC in the knee. Swiss Med Wkly, 2015, 145 (Suppl 210), 43S. (Clinical study)
- VOLZ, M., et al. A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- Geistlich Pharma AG data on file (Bench test)
- GILLE, J., et al. Cell-Laden and Cell-Free Matrix-Induced-Chondrogenesis versus Microfracture for the Treatment of Articular Cartilage Defects: A Histological and Biomechanical Study in Sheep. Cartilage OnlineFirst, January 7, 2010, doi:10.1177/1947603509358721 (Pre-clinical study)
- KRAMER, J., et al. In vivo matrix-guided human mesenchymal stem cells. Cell Mol Life Sci, Mar 2006, 63(5), 616-626. (Clinical study)
- MITHOEFER, K., et al. The microfracture technique for the sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- GOYAL, D., et al. Evidence-based status of microfracture technique: a systematic review of level I and II studies. Arthroscopy, Sep 2013, 29(9), 1579-1588. (Review of clinical studies)
- FONTANA, A., et al. Sustained five-year benefit of autologous matrix-induced chondrogenesis for femoral acetabular impingement-induced chondral lesions compared with microfracture treatment. Bone Joint J, May 2015, 97-B(5), 628-635. (Clinical study)
- GAO, L., et al. Early loss of subchondral bone following microfracture is counteracted by bone marrow aspirate in a translational model of osteochondral repair. Nature Scientif-ic Reports, 2017, 7:45189, DOI: 10.1038/srep45189 (Pre-clinical study)
- FRANK, R.M., et al., Failure of Bone Marrow Stimulation Techniques, Sports Med Arthrosc Rev, 2017, 25 (1) (Review of clinical studies)
- STEADMAN, J.R., Microfracture Technique for Full-Thickness Chondral Defects: Technique and Clinical Results. Operative Techniques in Orthopaedics. 1997. 7(4), 300-304. (Clinical study)
- KAISER, N., et al. Clinical results 10 years after AMIC in the knee. Swiss Med Wkly, 2015, 145 (Suppl 210), 43S. (Clinical study)
- VOLZ, M., et al. A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- SCHAGEMANN, J., et al. Mid-term outcome of arthroscopic AMIC for the treatment of articular cartilage defects in the knee joint is equivalent to mini-open procedures. Arch Orthop Trauma Surg, Jan 22 2018. (Clinical study)
- STEINWACHS, M.R.,et al. Systematic Review and Meta-Analysis of the Clinical Evidence on the Use of Autologous Matrix-Induced Chondrogenesis in the Knee. Cartilage. 2019:1947603519870846. https://www.ncbi.nlm.nih.gov/ pubmed/31508990 (Review of clinical studies)
- FOSSUM, V., et al. Collagen-Covered Autologous Chondrocyte Implantation Versus Autologous Matrix-Induced Chondrogenesis: A Randomized Trial Comparing 2 Methods for Repair of Cartilage Defects of the Knee. Orthopaedic Journal of Sports Medicine. 019;7(9):2325967119868212. doi.org/10.1177/2325967119868212 (Clinical study)
Referenzen
- SCHIAVONE PANNI, A., et al. Good clinical results with autologous matrix-induced chondrogenesis (Amic) technique in large knee chondral defects. Knee Surg Sports Traumatol Arthrosc, 2018 Apr 26(4):1130-36 (Clinical study)
- WALTHER, M., et al. Scaffold based reconstruction of focal full thickness talar cartilage defects. Clinical Research on Foot & Ankle, 2013, 1-5. (Clinical study)
- KAISER, N., et al. Clinical results 10 years after AMIC in the knee. Swiss Med Wkly, 2015, 145 (Suppl 210), 43S. (Clinical study)
- VOLZ, M., et al. A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- Geistlich Pharma AG data on file (Bench test)
- GILLE, J., et al. Cell-Laden and Cell-Free Matrix-Induced-Chondrogenesis versus Microfracture for the Treatment of Articular Cartilage Defects: A Histological and Biomechanical Study in Sheep. Cartilage OnlineFirst, January 7, 2010, doi:10.1177/1947603509358721 (Pre-clinical study)
- KRAMER, J., et al. In vivo matrix-guided human mesenchymal stem cells. Cell Mol Life Sci, Mar 2006, 63(5), 616-626. (Clinical study)
- MITHOEFER, K., et al. The microfracture technique for the sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- GOYAL, D., et al. Evidence-based status of microfracture technique: a systematic review of level I and II studies. Arthroscopy, Sep 2013, 29(9), 1579-1588. (Review of clinical studies)
- FONTANA, A., et al. Sustained five-year benefit of autologous matrix-induced chondrogenesis for femoral acetabular impingement-induced chondral lesions compared with microfracture treatment. Bone Joint J, May 2015, 97-B(5), 628-635. (Clinical study)
- GAO, L., et al. Early loss of subchondral bone following microfracture is counteracted by bone marrow aspirate in a translational model of osteochondral repair. Nature Scientif-ic Reports, 2017, 7:45189, DOI: 10.1038/srep45189 (Pre-clinical study)
- FRANK, R.M., et al., Failure of Bone Marrow Stimulation Techniques, Sports Med Arthrosc Rev, 2017, 25 (1) (Review of clinical studies)
- STEADMAN, J.R., Microfracture Technique for Full-Thickness Chondral Defects: Technique and Clinical Results. Operative Techniques in Orthopaedics. 1997. 7(4), 300-304. (Clinical study)
- KAISER, N., et al. Clinical results 10 years after AMIC in the knee. Swiss Med Wkly, 2015, 145 (Suppl 210), 43S. (Clinical study)
- VOLZ, M., et al. A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- SCHAGEMANN, J., et al. Mid-term outcome of arthroscopic AMIC for the treatment of articular cartilage defects in the knee joint is equivalent to mini-open procedures. Arch Orthop Trauma Surg, Jan 22 2018. (Clinical study)
- STEINWACHS, M.R.,et al. Systematic Review and Meta-Analysis of the Clinical Evidence on the Use of Autologous Matrix-Induced Chondrogenesis in the Knee. Cartilage. 2019:1947603519870846. https://www.ncbi.nlm.nih.gov/ pubmed/31508990 (Review of clinical studies)
- FOSSUM, V., et al. Collagen-Covered Autologous Chondrocyte Implantation Versus Autologous Matrix-Induced Chondrogenesis: A Randomized Trial Comparing 2 Methods for Repair of Cartilage Defects of the Knee. Orthopaedic Journal of Sports Medicine. 019;7(9):2325967119868212. doi.org/10.1177/2325967119868212 (Clinical study)
Mini-open Chirurgie, Prof. Dr. M. Steinwachs
Referenzen:
- SCHIAVONE PANNI, A., et al. Good clinical results with autologous matrix-induced chondrogenesis (Amic) technique in large knee chondral defects. Knee Surg Sports Traumatol Arthrosc, 2018 Apr 26(4):1130-36 (Clinical study)
- WALTHER, M., et al. Scaffold based reconstruction of focal full thickness talar cartilage defects. Clinical Research on Foot & Ankle, 2013, 1-5. (Clinical study)
- KAISER, N., et al. Clinical results 10 years after AMIC in the knee. Swiss Med Wkly, 2015, 145 (Suppl 210), 43S. (Clinical study)
- VOLZ, M., et al. A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- Geistlich Pharma AG data on file (Bench test)
- GILLE, J., et al. Cell-Laden and Cell-Free Matrix-Induced-Chondrogenesis versus Microfracture for the Treatment of Articular Cartilage Defects: A Histological and Biomechanical Study in Sheep. Cartilage OnlineFirst, January 7, 2010, doi:10.1177/1947603509358721 (Pre-clinical study)
- KRAMER, J., et al. In vivo matrix-guided human mesenchymal stem cells. Cell Mol Life Sci, Mar 2006, 63(5), 616-626. (Clinical study)
- MITHOEFER, K., et al. The microfracture technique for the sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- GOYAL, D., et al. Evidence-based status of microfracture technique: a systematic review of level I and II studies. Arthroscopy, Sep 2013, 29(9), 1579-1588. (Review of clinical studies)
- FONTANA, A., et al. Sustained five-year benefit of autologous matrix-induced chondrogenesis for femoral acetabular impingement-induced chondral lesions compared with microfracture treatment. Bone Joint J, May 2015, 97-B(5), 628-635. (Clinical study)
- GAO, L., et al. Early loss of subchondral bone following microfracture is counteracted by bone marrow aspirate in a translational model of osteochondral repair. Nature Scientif-ic Reports, 2017, 7:45189, DOI: 10.1038/srep45189 (Pre-clinical study)
- FRANK, R.M., et al., Failure of Bone Marrow Stimulation Techniques, Sports Med Arthrosc Rev, 2017, 25 (1) (Review of clinical studies)
- STEADMAN, J.R., Microfracture Technique for Full-Thickness Chondral Defects: Technique and Clinical Results. Operative Techniques in Orthopaedics. 1997. 7(4), 300-304. (Clinical study)
- KAISER, N., et al. Clinical results 10 years after AMIC in the knee. Swiss Med Wkly, 2015, 145 (Suppl 210), 43S. (Clinical study)
- VOLZ, M., et al. A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- SCHAGEMANN, J., et al. Mid-term outcome of arthroscopic AMIC for the treatment of articular cartilage defects in the knee joint is equivalent to mini-open procedures. Arch Orthop Trauma Surg, Jan 22 2018. (Clinical study)
- STEINWACHS, M.R.,et al. Systematic Review and Meta-Analysis of the Clinical Evidence on the Use of Autologous Matrix-Induced Chondrogenesis in the Knee. Cartilage. 2019:1947603519870846. https://www.ncbi.nlm.nih.gov/ pubmed/31508990 (Review of clinical studies)
- FOSSUM, V., et al. Collagen-Covered Autologous Chondrocyte Implantation Versus Autologous Matrix-Induced Chondrogenesis: A Randomized Trial Comparing 2 Methods for Repair of Cartilage Defects of the Knee. Orthopaedic Journal of Sports Medicine. 019;7(9):2325967119868212. doi.org/10.1177/2325967119868212 (Clinical study)
Arthroskopische Chirurgie, Prof. Dr. Justus Gille
Referenzen
- SCHIAVONE PANNI, A., et al. Good clinical results with autologous matrix-induced chondrogenesis (Amic) technique in large knee chondral defects. Knee Surg Sports Traumatol Arthrosc, 2018 Apr 26(4):1130-36 (Clinical study)
- WALTHER, M., et al. Scaffold based reconstruction of focal full thickness talar cartilage defects. Clinical Research on Foot & Ankle, 2013, 1-5. (Clinical study)
- KAISER, N., et al. Clinical results 10 years after AMIC in the knee. Swiss Med Wkly, 2015, 145 (Suppl 210), 43S. (Clinical study)
- VOLZ, M., et al. A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- Geistlich Pharma AG data on file (Bench test)
- GILLE, J., et al. Cell-Laden and Cell-Free Matrix-Induced-Chondrogenesis versus Microfracture for the Treatment of Articular Cartilage Defects: A Histological and Biomechanical Study in Sheep. Cartilage OnlineFirst, January 7, 2010, doi:10.1177/1947603509358721 (Pre-clinical study)
- KRAMER, J., et al. In vivo matrix-guided human mesenchymal stem cells. Cell Mol Life Sci, Mar 2006, 63(5), 616-626. (Clinical study)
- MITHOEFER, K., et al. The microfracture technique for the sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- GOYAL, D., et al. Evidence-based status of microfracture technique: a systematic review of level I and II studies. Arthroscopy, Sep 2013, 29(9), 1579-1588. (Review of clinical studies)
- FONTANA, A., et al. Sustained five-year benefit of autologous matrix-induced chondrogenesis for femoral acetabular impingement-induced chondral lesions compared with microfracture treatment. Bone Joint J, May 2015, 97-B(5), 628-635. (Clinical study)
- GAO, L., et al. Early loss of subchondral bone following microfracture is counteracted by bone marrow aspirate in a translational model of osteochondral repair. Nature Scientif-ic Reports, 2017, 7:45189, DOI: 10.1038/srep45189 (Pre-clinical study)
- FRANK, R.M., et al., Failure of Bone Marrow Stimulation Techniques, Sports Med Arthrosc Rev, 2017, 25 (1) (Review of clinical studies)
- STEADMAN, J.R., Microfracture Technique for Full-Thickness Chondral Defects: Technique and Clinical Results. Operative Techniques in Orthopaedics. 1997. 7(4), 300-304. (Clinical study)
- KAISER, N., et al. Clinical results 10 years after AMIC in the knee. Swiss Med Wkly, 2015, 145 (Suppl 210), 43S. (Clinical study)
- VOLZ, M., et al. A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- SCHAGEMANN, J., et al. Mid-term outcome of arthroscopic AMIC for the treatment of articular cartilage defects in the knee joint is equivalent to mini-open procedures. Arch Orthop Trauma Surg, Jan 22 2018. (Clinical study)
- STEINWACHS, M.R.,et al. Systematic Review and Meta-Analysis of the Clinical Evidence on the Use of Autologous Matrix-Induced Chondrogenesis in the Knee. Cartilage. 2019:1947603519870846. https://www.ncbi.nlm.nih.gov/ pubmed/31508990 (Review of clinical studies)
- FOSSUM, V., et al. Collagen-Covered Autologous Chondrocyte Implantation Versus Autologous Matrix-Induced Chondrogenesis: A Randomized Trial Comparing 2 Methods for Repair of Cartilage Defects of the Knee. Orthopaedic Journal of Sports Medicine. 019;7(9):2325967119868212. doi.org/10.1177/2325967119868212 (Clinical study)
Klinische Ergebnisse AMIC® Chondro-Gide® Knie
AMIC® Chondro-Gide® hat sich als wirksame Behandlungsmethode für die Reparatur von Knorpelläsionen im Knie bewährt. Klinische Studien belegen die erfolgreiche Behandlung mit AMIC® Chondro-Gide® bei mini-open sowie arthroskopischen Techniken während über zehn Jahren.14
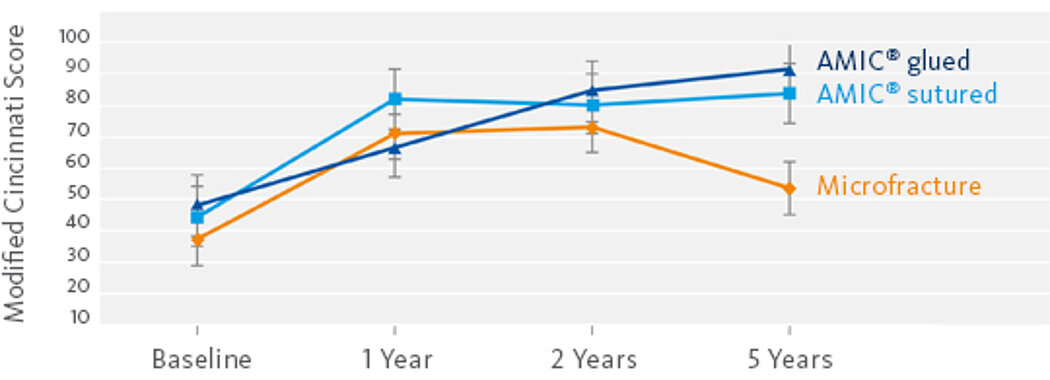
Bessere Ergebnisse als mit MFx allein, nach 2 Jahren
In einer randomisierten, kontrollierten, 3-armigen Studie mit 47 Patienten in 2 Zentren14 zeigte sich nach 2 Jahren MFx alleine (ohne Chondro-Gide®) eine signifikante Verschlechterung der Ergebnisse. Schmerz- und Funktionswerte (ICRS und modifizierte Cincinnati-Scores) blieben stabil oder verbesserten sich sogar mit AMIC®, während sie sich in der MFx Gruppe verschlechterten.
References
- SCHIAVONE PANNI, A., et al. Good clinical results with autologous matrix-induced chondrogenesis (Amic) technique in large knee chondral defects. Knee Surg Sports Traumatol Arthrosc, 2018 Apr 26(4):1130-36 (Clinical study)
- WALTHER, M., et al. Scaffold based reconstruction of focal full thickness talar cartilage defects. Clinical Research on Foot & Ankle, 2013, 1-5. (Clinical study)
- KAISER, N., et al. Clinical results 10 years after AMIC in the knee. Swiss Med Wkly, 2015, 145 (Suppl 210), 43S. (Clinical study)
- VOLZ, M., et al. A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- Geistlich Pharma AG data on file (Bench test)
- GILLE, J., et al. Cell-Laden and Cell-Free Matrix-Induced-Chondrogenesis versus Microfracture for the Treatment of Articular Cartilage Defects: A Histological and Biomechanical Study in Sheep. Cartilage OnlineFirst, January 7, 2010, doi:10.1177/1947603509358721 (Pre-clinical study)
- KRAMER, J., et al. In vivo matrix-guided human mesenchymal stem cells. Cell Mol Life Sci, Mar 2006, 63(5), 616-626. (Clinical study)
- MITHOEFER, K., et al. The microfracture technique for the sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- GOYAL, D., et al. Evidence-based status of microfracture technique: a systematic review of level I and II studies. Arthroscopy, Sep 2013, 29(9), 1579-1588. (Review of clinical studies)
- FONTANA, A., et al. Sustained five-year benefit of autologous matrix-induced chondrogenesis for femoral acetabular impingement-induced chondral lesions compared with microfracture treatment. Bone Joint J, May 2015, 97-B(5), 628-635. (Clinical study)
- GAO, L., et al. Early loss of subchondral bone following microfracture is counteracted by bone marrow aspirate in a translational model of osteochondral repair. Nature Scientif-ic Reports, 2017, 7:45189, DOI: 10.1038/srep45189 (Pre-clinical study)
- FRANK, R.M., et al., Failure of Bone Marrow Stimulation Techniques, Sports Med Arthrosc Rev, 2017, 25 (1) (Review of clinical studies)
- STEADMAN, J.R., Microfracture Technique for Full-Thickness Chondral Defects: Technique and Clinical Results. Operative Techniques in Orthopaedics. 1997. 7(4), 300-304. (Clinical study)
- KAISER, N., et al. Clinical results 10 years after AMIC in the knee. Swiss Med Wkly, 2015, 145 (Suppl 210), 43S. (Clinical study)
- VOLZ, M., et al. A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- SCHAGEMANN, J., et al. Mid-term outcome of arthroscopic AMIC for the treatment of articular cartilage defects in the knee joint is equivalent to mini-open procedures. Arch Orthop Trauma Surg, Jan 22 2018. (Clinical study)
- STEINWACHS, M.R.,et al. Systematic Review and Meta-Analysis of the Clinical Evidence on the Use of Autologous Matrix-Induced Chondrogenesis in the Knee. Cartilage. 2019:1947603519870846. https://www.ncbi.nlm.nih.gov/ pubmed/31508990 (Review of clinical studies)
- FOSSUM, V., et al. Collagen-Covered Autologous Chondrocyte Implantation Versus Autologous Matrix-Induced Chondrogenesis: A Randomized Trial Comparing 2 Methods for Repair of Cartilage Defects of the Knee. Orthopaedic Journal of Sports Medicine. 019;7(9):2325967119868212. doi.org/10.1177/2325967119868212 (Clinical study)
Vergleichbar gute Resultate bei arthroskopischen und Mini-open-Eingriffen
In einer retrospektiven Studie verglichen Schagemann et al.16 die klinischen Ergebnisse von AMIC® Chondro-Gide® Prozeduren, die als mini-open oder arthroskopische Eingriffe ausgeführt wurden. Die Studie beobachtete Patienten über einen Zeitraum von 2 Jahren. Gemäss den Visuellen Analogwerten (VAS), Lysholm-Scores sowie Knee injury and Osteoarthrithis Outcome Scores (KOOS) der Patienten bringen beide chirurgischen Ansätze vergleichbar positive Ergebnisse hervor.
Erste Meta-Analyse von 12 AMIC® Chondro-Gide® Studien mit 375 Patienten
2019 evaluierten die Autoren in einer systematischen Meta-Analyse von AMIC® Resultaten chondrale und osteochondrale Läsionen Grad III/IV im Knie mit einer durchschnittlichen Defektgrösse von 4.24 cm2 und bis zu 7 Jahren Nachuntersuchung. Der Einsatz von AMIC® Chondro-Gide® bei Defektgrössen, die über der empfohlenen Grenze für MFx liegen, reduzierte Schmerzen signifikant und verbesserte die Funktionswerte von Studienbeginn bis zur Nachuntersuchung.
Die Meta-Analyse dokumentiert, dass das AMIC® Chondro-Gide® Verfahren Schmerzen und funktionale Resultate bei Kniegelenken mit chondralen oder osteochondralen Läsionen signifikant verbessert. Die Ergebnisse zeigen weiter, dass die Verbesserung länger als 5 Jahre erhalten blieb, was den langfristigen Erfolg von AMIC® Chondro-Gide® bei grösseren (>4 cm2) Läsionen Grad III und IV bestätigt.17
ACI-C und AMIC® Chondro-Gide® zeigen gleich gute Resultate nach 2 Jahren
Jüngst führten Fossum, et al., (2019) eine prospektive, randomisierte, kontrollierte Studie durch, um die Resultate von ACI-C und AMIC® bei chondralen und osteochondralen Defekten des distalen Femurs und der Patella zu beurteilen. Nach 1 und 2 Jahren konnten keine signifikanten Unterschiede bei den Ergebnissen der ACI-C und AMIC® Techniken festgestellt werden. Die Autoren schlossen daraus, dass AMIC® als klinisch gleichwertige, aber günstigere Alternative zu ACI-C betrachtet werden kann. Dies weil AMIC® als einzeitiges Verfahren weit weniger ressourcenintensiv ist.18
References
- SCHIAVONE PANNI, A., et al. Good clinical results with autologous matrix-induced chondrogenesis (Amic) technique in large knee chondral defects. Knee Surg Sports Traumatol Arthrosc, 2018 Apr 26(4):1130-36 (Clinical study)
- WALTHER, M., et al. Scaffold based reconstruction of focal full thickness talar cartilage defects. Clinical Research on Foot & Ankle, 2013, 1-5. (Clinical study)
- KAISER, N., et al. Clinical results 10 years after AMIC in the knee. Swiss Med Wkly, 2015, 145 (Suppl 210), 43S. (Clinical study)
- VOLZ, M., et al. A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- Geistlich Pharma AG data on file (Bench test)
- GILLE, J., et al. Cell-Laden and Cell-Free Matrix-Induced-Chondrogenesis versus Microfracture for the Treatment of Articular Cartilage Defects: A Histological and Biomechanical Study in Sheep. Cartilage OnlineFirst, January 7, 2010, doi:10.1177/1947603509358721 (Pre-clinical study)
- KRAMER, J., et al. In vivo matrix-guided human mesenchymal stem cells. Cell Mol Life Sci, Mar 2006, 63(5), 616-626. (Clinical study)
- MITHOEFER, K., et al. The microfracture technique for the sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- GOYAL, D., et al. Evidence-based status of microfracture technique: a systematic review of level I and II studies. Arthroscopy, Sep 2013, 29(9), 1579-1588. (Review of clinical studies)
- FONTANA, A., et al. Sustained five-year benefit of autologous matrix-induced chondrogenesis for femoral acetabular impingement-induced chondral lesions compared with microfracture treatment. Bone Joint J, May 2015, 97-B(5), 628-635. (Clinical study)
- GAO, L., et al. Early loss of subchondral bone following microfracture is counteracted by bone marrow aspirate in a translational model of osteochondral repair. Nature Scientif-ic Reports, 2017, 7:45189, DOI: 10.1038/srep45189 (Pre-clinical study)
- FRANK, R.M., et al., Failure of Bone Marrow Stimulation Techniques, Sports Med Arthrosc Rev, 2017, 25 (1) (Review of clinical studies)
- STEADMAN, J.R., Microfracture Technique for Full-Thickness Chondral Defects: Technique and Clinical Results. Operative Techniques in Orthopaedics. 1997. 7(4), 300-304. (Clinical study)
- KAISER, N., et al. Clinical results 10 years after AMIC in the knee. Swiss Med Wkly, 2015, 145 (Suppl 210), 43S. (Clinical study)
- VOLZ, M., et al. A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, Apr 2017, 41(4), 797-804. (Clinical study)
- SCHAGEMANN, J., et al. Mid-term outcome of arthroscopic AMIC for the treatment of articular cartilage defects in the knee joint is equivalent to mini-open procedures. Arch Orthop Trauma Surg, Jan 22 2018. (Clinical study)
- STEINWACHS, M.R.,et al. Systematic Review and Meta-Analysis of the Clinical Evidence on the Use of Autologous Matrix-Induced Chondrogenesis in the Knee. Cartilage. 2019:1947603519870846. https://www.ncbi.nlm.nih.gov/ pubmed/31508990 (Review of clinical studies)
- FOSSUM, V., et al. Collagen-Covered Autologous Chondrocyte Implantation Versus Autologous Matrix-Induced Chondrogenesis: A Randomized Trial Comparing 2 Methods for Repair of Cartilage Defects of the Knee. Orthopaedic Journal of Sports Medicine. 019;7(9):2325967119868212. doi.org/10.1177/2325967119868212 (Clinical study)